Egenskaper til ionekanaler
Selektivitet er den selektivt økte permeabiliteten til IR for visse ioner. For andre ioner er permeabiliteten redusert. Slik selektivitet bestemmes av det selektive filteret - det smaleste punktet i kanalporen. Filteret kan i tillegg til smale dimensjoner også ha en lokal elektrisk ladning. For eksempel har kationselektive kanaler vanligvis negativt ladede aminosyrerester i proteinmolekylet i området for deres selektive filter, som tiltrekker positive kationer og frastøter negative anioner, og hindrer dem i å passere gjennom poren.
Kontrollert permeabilitet er evnen til IC-en til å åpne eller lukke under visse kontrollhandlinger på kanalen. En lukket kanal har redusert permeabilitet, og en åpen kanal har en økt. I henhold til denne egenskapen kan IC-er klassifiseres avhengig av metodene for oppdagelsen deres: for eksempel potensialaktivert, ligandaktivert, etc.
Inaktivering er evnen til IC-er til automatisk å senke permeabiliteten en tid etter åpningen, selv om aktiveringsfaktoren som åpnet dem fortsetter å fungere. Rask inaktivering er en spesiell prosess med sin egen spesifikke mekanisme, forskjellig fra langsom kanallukking (langsom inaktivering). Lukking (langsom inaktivering) av kanalen skjer på grunn av prosesser som er motsatte av prosessene som sikret dens åpning, dvs. ved å endre konformasjonen til kanalproteinet. Men for eksempel i spenningsaktiverte kanaler skjer rask inaktivering ved hjelp av en spesiell molekylær plugg, som ligner en plugg på en kjede, som vanligvis brukes i bad. Denne pluggen er en aminosyresløyfe (polypeptid) med en fortykkelse i enden i form av tre aminosyrer, som lukker den indre munnen av kanalen fra siden av cytoplasmaet. Det er grunnen til at spenningsavhengige IC-er for natrium, som sikrer utvikling av et aksjonspotensial og bevegelse av en nerveimpuls, kan slippe natriumioner inn i cellen bare i noen få millisekunder, og deretter lukkes de automatisk av deres molekylære plugger, til tross for at depolariseringen som åpner dem fortsetter å virke. En annen mekanisme for CI-inaktivering kan være modifisering av den intracellulære munnen til kanalen med ytterligere underenheter.
Blokkering er evnen til IR under påvirkning av blokkerende stoffer til å fikse en av tilstandene og ikke reagere på vanlige kontrollhandlinger. I denne tilstanden slutter kanalen ganske enkelt å svare på kontrollhandlinger. Blokkering er forårsaket av blokkerende stoffer, som kan kalles antagonister, blokkere eller lytika. Antagonister er stoffer som forhindrer den aktiverende virkningen av andre stoffer på IC. Slike stoffer er i stand til å binde seg godt til IR-reseptorstedet, men er ikke i stand til å endre tilstanden til kanalen og forårsake dens respons. Det viser seg blokkeringen av reseptoren og, sammen med den, blokkeringen av IR. Det skal huskes at antagonister ikke nødvendigvis forårsaker fullstendig blokkering av reseptoren og dens IR, de kan virke svakere og kun hemme (undertrykke) kanalen, men ikke stoppe den helt Agonist-antagonister er stoffer som har en svak stimulerende effekt på reseptoren, men samtidig blokkere virkningen av naturlige endogene kontrollstoffer. Blokkere er stoffer som forhindrer driften av en ionekanal, for eksempel interaksjonen mellom en mediator og en molekylær reseptor for den, og derfor forstyrrer kanalkontrollen og blokkerer den. For eksempel blokkeres virkningen av acetylkolin av antikolinergika; noradrenalin med adrenalin - blokkere; histamin - histaminblokkere osv. Mange blokkere brukes til terapeutiske formål som medikamenter. Lytika er de samme blokkere, begrepet er eldre og brukes som et synonym for en blokker: antikolinerg, adrenolytisk, etc.
Plastisitet er evnen til en IC til å endre dens egenskaper, dens egenskaper. Den vanligste mekanismen som gir plastisitet er fosforylering av aminosyrene til kanalproteiner fra innsiden av membranen ved hjelp av proteinkinase-enzymer. Fosforrester fra ATP eller GTP festes til kanalproteiner – og kanalen endrer sine egenskaper. For eksempel er den festet i en permanent lukket tilstand, eller omvendt i en åpen tilstand.
12. Ionekanaler...
Ionekanalen består av flere underenheter, deres antall i en enkelt ionekanal varierer fra 3 til 12 underenheter. Ved sin organisasjon kan underenhetene som er inkludert i kanalen være homologe (av samme type), et antall kanaler dannes av underenheter av forskjellige typer.
Hver av underenhetene består av flere (tre eller flere) transmembransegmenter (ikke-polare deler vridd i α-helikser), av ekstra- og intracellulære løkker og terminalseksjoner av domener (representert av polare områder av molekyler som danner et domene og stikker ut utover bilipidlaget av membranen).
Hvert av transmembransegmentene, ekstra- og intracellulære løkker og terminale seksjoner av domener utfører sin egen funksjon.
Dermed bestemmer transmembransegmentet 2, organisert i form av en a-helix, selektiviteten til kanalen.
De terminale områdene i domenet fungerer som sensorer for ekstra- og intracellulære ligander, og et av transmembransegmentene spiller rollen som en spenningsavhengig sensor.
De tredje transmembransegmentene i underenheten er ansvarlige for driften av portalkanalsystemet, etc.
Ionekanaler fungerer ved hjelp av mekanismen for tilrettelagt diffusjon. Når kanalene aktiveres, følger bevegelsen av ioner langs dem en konsentrasjonsgradient. Bevegelseshastigheten gjennom membranen er 10 ioner per sekund.
Spesifisitet av ionekanaler.
De fleste av dem er selektive, dvs. kanaler som lar bare én type ion passere (natriumkanaler, kaliumkanaler, kalsiumkanaler, anionkanaler).
kanalselektivitet.
Kanalselektivitet bestemmes av tilstedeværelsen av et selektivt filter.
Dens rolle spilles av den første delen av kanalen, som har en viss ladning, konfigurasjon og størrelse (diameter), som lar bare en viss type ioner passere inn i kanalen.
Noen av ionekanalene er ikke-selektive, for eksempel "lekkasjekanaler". Dette er membrankanaler som i hvile, langs konsentrasjonsgradienten, K + -ioner forlater cellen, men gjennom disse kanalene kommer en liten mengde Na + -ioner også inn i cellen i ro langs konsentrasjonsgradienten.
Ionekanalsensor.
Ionekanalsensoren er en følsom del av kanalen som oppfatter signaler, hvis natur kan være forskjellig.
På dette grunnlaget er det:
spenningsstyrte ionekanaler;
reseptor-gatede ionekanaler;
ligandkontrollert (ligandavhengig);
mekanisk styrt (mekanisk avhengig).
Kanaler som har en sensor kalles kontrollerte. Noen kanaler har ikke sensor. Slike kanaler kalles uadministrerte.
Portsystemet til ionekanalen.
Kanalen har en port som er lukket i hvile og åpnes når et signal påføres. I noen kanaler skilles det mellom to typer porter: aktivering (m-porter) og inaktivering (h-porter).
Det er tre tilstander av ionekanaler:
en hviletilstand når porten er lukket og kanalen er utilgjengelig for ioner;
aktiveringstilstanden, når portsystemet er åpent og ioner beveger seg gjennom membranen langs kanalen;
inaktiveringstilstanden, når kanalen er lukket og ikke reagerer på stimuli.
Ledningshastighet (konduktivitet).
Det er raske og langsomme kanaler. Lekkasjekanaler er langsomme, natriumkanaler i nevroner er raske.
I membranen til enhver celle er det et stort sett med forskjellige (i form av hastighet) ionekanaler, hvis aktivering bestemmer den funksjonelle tilstanden til cellene.
spenningsstyrte kanaler.
Potensielt kontrollert kanal består av:
selektivt filter;
aktiverings- og inaktiveringsporter;
spenningssensor.
porer fylt med vann;
Kanaldiameteren er mye større enn ionediameteren; i den selektive filtersonen smalner den til atomstørrelser, noe som sikrer at denne delen av kanalen utfører funksjonen til et selektivt filter.
Åpning og lukking av portmekanismen skjer når membranpotensialet endres, og porten åpner ved en verdi av membranpotensialet, og lukker på et annet nivå av membranpotensialet.
Det antas at endringen i det elektriske feltet til membranen oppfattes av en spesiell del av kanalveggen, som kalles spenningssensoren.
En endring i tilstanden, på grunn av en endring i nivået av membranpotensialet, forårsaker konformasjonen av proteinmolekylene som danner kanalen, og fører som et resultat til åpning eller lukking av porten til ionekanalen.
Kanaler (natrium, kalsium, kalium) har fire homologe domener - underenheter (I, II, III, IV). Domenet (for eksempel natriumkanaler) består av seks transmembrane segmenter organisert i form av a-helikser, som hver spiller sin egen rolle.
Dermed spiller transmembransegmentet 5 rollen som en pore, transmembransegmentet 4 er en sensor som reagerer på endringer i membranpotensialet, og andre transmembransegmenter er ansvarlige for aktivering og inaktivering av portalkanalsystemet. Inntil slutten har ikke rollen til individuelle transmembrane segmenter og underenheter blitt studert.
Natriumkanaler (innvendig diameter 0,55 nm) er tilstede i cellene i eksiterbare vev. Tetthet per 1 µm 2 i forskjellige vev er ikke det samme.
Så i ikke-myeliniserte nervefibre er det 50-200 kanaler, og i myeliniserte nervefibre (Ranvier intercepts) - 13 000 per 1 mikron 2 membranområde. Ved hvile er de stengt. Membranpotensialet er 70-80 mV.
Eksponering for en stimulus endrer membranpotensialet og aktiverer en spenningsstyrt natriumkanal.
Den aktiveres når membranpotensialet skifter fra hvilepotensialnivået mot det kritiske nivået av depolarisering.
En sterk natriumstrøm gir et skifte i membranpotensialet til et kritisk nivå av depolarisering (CDL).
Endring i membranpotensial opp til -50-40 mV, dvs. til nivået av et kritisk nivå av depolarisering, forårsaker åpning av andre spenningsavhengige Na +-kanaler, gjennom hvilke den innkommende natriumstrømmen utføres, som danner "toppen" av aksjonspotensialet.
Natriumioner beveger seg inn i cellen langs konsentrasjonsgradienten og den kjemiske gradienten gjennom kanalen, og danner den såkalte innkommende natriumstrømmen, som fører til videre rask utvikling av depolarisasjonsprosessen.
Membranpotensial endrer fortegn til motsatt +10-20 mV. Et positivt membranpotensial fører til at natriumkanaler lukkes og inaktiveres.
Potensialavhengige Na+-kanaler spiller en ledende rolle i dannelsen av aksjonspotensialet, dvs. eksitasjonsprosessen i cellen.
Kalsiumioner hindrer åpningen av spenningsstyrte natriumkanaler ved å endre responsparametrene.
TIL + -kanaler
Kaliumkanaler (indre diameter 0,30 nm) er tilstede i cytoplasmatiske membraner, et betydelig antall kanaler for kalium "lekkasje" fra cellen ble funnet.
I hvile er de åpne. Gjennom dem, i hvile, "lekker" kalium fra cellen langs konsentrasjonsgradienten og den elektrokjemiske gradienten.
Denne prosessen omtales som den utgående kaliumstrømmen, som fører til dannelsen av et membranhvilepotensial (-70-80 mV). Disse kaliumkanalene kan kun betinget klassifiseres som spenningsavhengige.
Når membranpotensialet endres under depolarisering, inaktiveres kaliumstrømmen.
Under repolarisering dannes en innkommende K + strøm gjennom spenningsavhengige kanaler, som kalles K + strøm for forsinket likeretting.
En annen type spenningsstyrte K+-kanaler. En rask utadgående kaliumstrøm oppstår langs dem i underterskelområdet til membranpotensialet (positivt sporpotensial). Kanalinaktivering oppstår på grunn av sporhyperpolarisering.
En annen type spenningsstyrte kaliumkanaler aktiveres først etter foreløpig hyperpolarisering, den danner en rask forbigående kaliumstrøm, som raskt inaktiveres.
Kalsiumioner letter åpningen av spenningsstyrte kaliumkanaler ved å endre responsparametrene.
Sa + -kanaler.
Potensial-gatede kanaler gir et betydelig bidrag både til regulering av kalsiuminntrengning i cytoplasma og til elektrogenese.
Proteiner som danner kalsiumkanaler består av fem underenheter (al, a2, b, g, d).
Hovedunderenheten danner selve kanalen og inneholder bindingsseter for ulike kalsiumkanalmodulatorer.
Flere strukturelt distinkte kalsiumkanal-al-underenheter er funnet i pattedyrs nerveceller (betegnet A, B, C, D og E).
Funksjonelt skiller forskjellige typer kalsiumkanaler seg fra hverandre i aktivering, kinetikk, enkeltkanals konduktans og farmakologi.
Opptil seks typer spenningsstyrte kalsiumkanaler er beskrevet i celler (T-, L-, N-, P-, Q-, R-kanaler).
Aktiviteten til spenningsstyrte plasmamembrankanaler reguleres av forskjellige intracellulære sekundære budbringere og membranbundne G-proteiner.
Kalsiumspenningsstyrte kanaler finnes i stort antall i cytoplasmatiske membraner til nevroner, myocytter av glatte, tverrstripete og hjertemuskler, og i membranene i det endoplasmatiske retikulum.
Ca 2+ -kanaler av SPR er oligomere proteiner innebygd i SPR-membranen.
Sa 2+ - kontrollert Sa 2+ - SPR-kanaler.
Disse kalsiumkanalene ble først isolert fra skjelett- og hjertemuskler.
Det viste seg at Ca 2+ -kanaler av SPR i disse muskelvevet har molekylære forskjeller og er kodet av forskjellige gener.
Ca 2+ -kanaler av SPR i hjertemuskulaturen er direkte forbundet med høyterskel Ca 2+ -kanaler i plasmamembranen (L-type) gjennom kalsiumbindende proteiner, og danner dermed en funksjonelt aktiv struktur - en "triade".
I skjelettmuskulaturen aktiverer plasmalemma-depolarisering direkte frigjøringen av Ca 2+ fra det endoplasmatiske retikulumet på grunn av det faktum at Ca 2+-kanalene i plasmamembranen fungerer som spenningsfølsomme sendere av aktiveringssignalet direkte til Ca 2+-kanalene til SPR gjennom binding av proteiner.
Ca 2+ -depoter av skjelettmuskulatur har således en depolarisasjonsindusert Ca 2+ frigjøringsmekanisme (RyRl-type).
I motsetning til skjelettmuskulaturen er endoplasmatiske Ca 2+ kanaler av kardiomyocytter ikke assosiert med plasmamembranen, og stimulering av Ca 2+ frigjøring fra depotet krever en økning i konsentrasjonen av cytosolisk kalsium (RyR2 type).
I tillegg til disse to typene Ca 2+ -aktiverte Ca 2h-kanaler, er det nylig identifisert en tredje type Ca 2+ SPR-kanaler (RyR3-type), som ennå ikke er tilstrekkelig studert.
Alle kalsiumkanaler er preget av langsom aktivering og langsom inaktivering sammenlignet med natriumkanaler.
Når muskelcellen er depolarisert (fremspring av de cytoplasmatiske membranene - T-tubuli nærmer seg membranene i det endoplasmatiske retikulum), oppstår en spenningsavhengig åpning av kalsiumkanalene til membranene til det sarkoplasmatiske retikulum.
Siden på den ene siden er kalsiumkonsentrasjonen i SPR høy (kalsiumdepot), og kalsiumkonsentrasjonen i cytoplasmaet er lav, og på den annen side området til SPR-membranen og tettheten av kalsium kanalene i den er store, kalsiumnivået i cytoplasmaet øker 100 ganger.
Denne økningen i kalsiumkonsentrasjon initierer prosessen med sammentrekning av myofibriller.
Kalsiumkanaler i kardiomyocytter er lokalisert i den cytoplasmatiske membranen og er L-type kalsiumkanaler.
De aktiveres ved et membranpotensial på +20-40 mV, danner en innkommende kalsiumstrøm. De er i aktivert tilstand i lang tid, danner et "platå" av kardiomyocyttaksjonspotensialet.
anionkanaler.
Det største antallet kanaler for klor i cellemembranen. Det er færre kloridioner i cellen sammenlignet med det intercellulære miljøet. Derfor, når kanalene åpner seg, kommer klor inn i cellen langs konsentrasjonsgradienten og den elektrokjemiske gradienten.
Antall kanaler for HCO 3 er ikke så stort, volumet av transport av dette anion gjennom kanalene er mye mindre.
ionebyttere.
Membranen inneholder ionebyttere (bærerproteiner) som utfører tilrettelagt diffusjon av ioner, d.v.s. akselerert koblet bevegelse av ioner gjennom biomembranen langs konsentrasjonsgradienten, slike prosesser er ATP-uavhengige.
De mest kjente er Na + -H +, K + -H +, Ca 2+ -H + vekslere, samt vekslere som gir utveksling av kationer for anioner Na + -HCO- 3, 2CI-Ca 2+ og vekslere som sørge for utveksling av kation for kation (Na + -Ca 2+) eller anion per anion (Cl- HCO3).
Reseptor-gatede ionekanaler.
Ligand-gatede (ligand-gatede) ionekanaler.
Ligand-gatede ionekanaler er en underart av reseptor-gatede kanaler og er alltid kombinert med en reseptor for et biologisk aktivt stoff (BAS).
Reseptorene til de betraktede kanalene tilhører den ionotrope typen membranreseptorer, når de interagerer med biologisk aktive stoffer (ligander), oppstår det raske reaksjoner.
En ligand-gated ionekanal består av:
porer fylt med vann;
selektivt filter;
aktivering gate;
ligandbindingssete (reseptor). Høyenergiaktiv BAS har en høy
affinitet (affinitet) for en bestemt type reseptor. Når ionekanaler aktiveres, beveger visse ioner seg langs en konsentrasjonsgradient og en elektrokjemisk gradient.
I en membranreseptor kan ligandbindingsstedet være tilgjengelig for liganden fra den ytre overflaten av membranen.
I dette tilfellet fungerer hormoner og parahormoner, ioner som en ligand.
Så når N-kolinerge reseptorer aktiveres, aktiveres natriumkanaler.
Kalsiumpermeabilitet initieres av nevronale acetylkolin-gatede, glutamat-gatede (NMDA og AMPA/kainattyper) reseptorer og purinreseptorer.
GABAA-reseptorer er koblet til ioniske kloridkanaler, og glycinreseptorer er også koblet til kloridkanaler.
I en membranreseptor kan ligandbindingssetet være tilgjengelig for ligander fra den indre overflaten av membranen.
I dette tilfellet fungerer proteinkinaser aktivert av andre budbringere eller andre budbringere selv som ligander.
Så proteinkinaser A, C, G, ved fosforylering av kationkanalproteiner, endrer deres permeabilitet.
Mekanisk styrte ionekanaler.
Mekanisk kontrollerte ionekanaler endrer deres ledningsevne for ioner enten ved å endre spenningen i bilipidlaget eller gjennom cellecytoskjelettet. Mange mekanisk kontrollerte kanaler er assosiert med mekanoreseptorer; de finnes i auditive celler, muskelspindler og vaskulært endotel.
Alle mekanisk styrte kanaler er delt inn i to grupper:
strekkaktiverte celler (SAC);
strekk-inaktiverte celler (SIC).
Mekanisk styrte kanaler har alle hovedkanalfunksjonene:
pore fylt med vann;
gate mekanisme;
strekksensor.
Når kanalen er aktivert, beveger ioner seg langs konsentrasjonsgradienten langs den.
Natrium, kalium ATPase.
Natrium, kalium ATPase (natrium-kalium pumpe, natrium-kalium pumpe).
Består av fire transmembrane domener: to α-subenheter og to β-subenheter. α-underenheten er et stort domene og β-underenheten er et lite. Under ionetransport blir store underenheter fosforylert og ioner beveger seg gjennom dem.
Natrium, kalium ATPase spiller en avgjørende rolle for å opprettholde natrium- og kaliumhomeostase i det intra- og ekstracellulære miljøet:
opprettholder et høyt nivå av K + og et lavt nivå av Na + i cellen;
deltar i dannelsen av hvilemembranpotensialet, i genereringen av aksjonspotensialet;
gir Na + konjugert transport av de fleste organiske stoffer gjennom membranen (sekundær aktiv transport);
påvirker homeostasen til H 2 O betydelig.
Natrium, kalium ATPase, gir det viktigste bidraget til dannelsen av ioneasymmetri i ekstra- og intracellulære rom.
Det fasede arbeidet til natrium- og kaliumpumpen gir en ikke-ekvivalent utveksling av kalium og natrium over membranen.
Sa + -ATPase (pumpe).
Det er to familier av Ca 2+ pumper som er ansvarlige for eliminering av Ca 2+ ioner fra cytoplasmaet: Ca 2+ pumpene til plasmamembranen og Ca 2+ pumpene i det endoplasmatiske retikulum.
Selv om de tilhører samme familie av proteiner (den såkalte P-klassen av ATPaser), viser disse pumpene noen forskjeller i struktur, funksjonell aktivitet og farmakologi.
Det finnes i store mengder i den cytoplasmatiske membranen. I cytoplasmaet til cellen i hvile er kalsiumkonsentrasjonen 10-7 mol/l, og utenfor cellen er den mye mer -10-3 mol/l.
En slik signifikant forskjell i konsentrasjoner opprettholdes på grunn av arbeidet til den cytoplasmatiske Ca++ -ATPasen.
Aktiviteten til Ca 2+ -pumpen til plasmamembranen styres direkte av Ca 2+ : en økning i konsentrasjonen av fritt kalsium i cytosolen aktiverer Ca 2+ -pumpen.
I hvile forekommer nesten ikke diffusjon gjennom kalsiumionekanaler.
Ca-ATPase transporterer Ca fra cellen til det ekstracellulære miljøet mot konsentrasjonsgradienten. Langs gradienten kommer Ca + inn i cellen på grunn av diffusjon gjennom ionekanaler.
Membranen til det endoplasmatiske retikulum inneholder også en stor mengde Ca++ -ATPase.
Kalsiumpumpen til endoplasmatisk retikulum (SERCA) sørger for fjerning av kalsium fra cytosol til endoplasmatisk retikulum – "depot" av kalsium på grunn av primær aktiv transport.
I depotet binder kalsium seg til kalsiumbindende proteiner (calsequestrin, calreticulin, etc.).
Minst tre forskjellige isoformer av SERCA-pumper har blitt beskrevet så langt.
SERCA1-subtypen er utelukkende konsentrert i raske skjelettmuskler, mens SERCA2-pumpene er utbredt i andre vev. Betydningen av SERCA3-pumper er mindre klar.
SERCA2-nacos-proteiner er delt inn i to forskjellige isoformer: SERCA2a, karakteristisk for kardiomyocytter og glatte muskler, og SERCA2b, karakteristisk for hjernevev.
En økning i Ca 2+ i cytosol aktiverer opptaket av kalsiumioner i det endoplasmatiske retikulum, mens en økning i fritt kalsium i det endoplasmatiske retikulum hemmer SERCA-pumpene.
H + K + -ATPase (pumpe).
Ved hjelp av denne pumpen (som et resultat av hydrolysen av ett ATP-molekyl) i slimhinnen (parietalcellene) i mageslimhinnen, transporteres to kaliumioner fra det ekstracellulære rommet til cellen og to H+-ioner fra cytosolen. til det ekstracellulære rommet under hydrolysen av ett molekyl. Denne mekanismen ligger til grunn for dannelsen av saltsyre i magen.
IonepumpeklasseF.
Mitokondriell ATPase. Katalyserer det siste trinnet i ATP-syntese. Mitokondrielle krypter inneholder ATP-syntase, som kobler oksidasjon i Krebs-syklusen og ADP-fosforylering til ATP.
IonepumpekvalitetV.
Lysosomal H + -ATPase (lysosomal protonpumper) - protonpumper som sørger for transport av H + fra cytosol til en rekke lysosomorganeller, Golgi-apparatet, sekretoriske vesikler. Som et resultat synker pH-verdien for eksempel i lysosomer til 5,0, noe som optimerer aktiviteten til disse strukturene.
Funksjoner ved ionetransport
1. Betydelig og asymmetrisk transmembran! gradient for Na+ og K+ i hvile.
Natrium utenfor cellen (145 mmol/l) er 10 ganger større enn i cellen (14 mmol/l).
Det er omtrent 30 ganger mer kalium i cellen (140 mmol/l) enn utenfor cellen (4 mmol/l).
Denne funksjonen ved fordelingen av natrium- og kaliumioner:
homeostatisert av arbeidet til Na + /K + -nacoca;
danner i ro den utgående kaliumstrømmen (lekkasjekanal);
genererer hvilepotensial;
arbeidet til eventuelle kaliumkanaler (spenningsavhengig, kalsiumavhengig, ligandavhengig) er rettet mot dannelsen av den utgående kaliumstrømmen.
Dette returnerer enten tilstanden til membranen til sitt opprinnelige nivå (aktivering av spenningsavhengige kanaler i repolariseringsfasen), eller hyperpolariserer membranen (kalsiumavhengige, ligandavhengige kanaler, inkludert de som aktiveres av systemer med andre mediatorer).
Det bør huskes at:
bevegelsen av kalium over membranen utføres ved passiv transport;
dannelsen av eksitasjon (aksjonspotensial) er alltid på grunn av den innkommende natriumstrømmen;
aktivering av eventuelle natriumkanaler forårsaker alltid en innadgående natriumstrøm;
bevegelsen av natrium over membranen utføres nesten alltid ved passiv transport;
i epitelceller som danner en vegg av ulike rør og hulrom i vev (tynntarm, nefrontubuli, etc.), i den ytre membranen er det alltid et stort antall natriumkanaler som gir en innkommende natriumstrøm når de aktiveres, og i kjellermembran - et stort antall natrium-, kaliumpumper som pumper natrium ut av cellen. En slik asymmetrisk fordeling av disse transportsystemene for natrium sikrer dens transcellulære transport, dvs. fra tarmens lumen, nyretubuli inn i det indre miljøet i kroppen;
passiv transport av natrium inn i cellen langs den elektrokjemiske gradienten fører til akkumulering av energi, som brukes til sekundær aktiv transport av mange stoffer.
2. Lavt nivå av kalsium i cytosolen til cellen.
I cellen i hvile er kalsiuminnholdet (50 nmol/l) 5000 ganger lavere enn utenfor cellen (2,5 mmol/l).
Et så lavt nivå av kalsium i cytosolen er ikke tilfeldig, siden kalsium i konsentrasjoner 10–100 ganger høyere enn den opprinnelige fungerer som en andre intracellulær mediator i signalrealisering.
Under slike forhold er en rask økning av kalsium i cytosolen mulig på grunn av aktivering av kalsiumkanaler (tilrettelagt diffusjon), som er tilstede i store mengder i den cytoplasmatiske membranen og i membranen til endoplasmatisk retikulum (endoplasmatisk retikulum - "depot" " av kalsium i cellen).
Dannelsen av kalsiumflukser, som oppstår på grunn av åpning av kanaler, gir en fysiologisk signifikant økning i kalsiumkonsentrasjonen i cytosolen.
Det lave nivået av kalsium i cytosolen til cellen opprettholdes av Ca 2+ -ATPase, Na + /Ca 2+ -utvekslere, kalsiumbindende proteiner i cytosolen.
I tillegg til den raske bindingen av cytosolisk Ca 2+ av intracellulære Ca 2+-bindende proteiner, kan kalsiumioner som kommer inn i cytosolen akkumuleres av Golgi-apparatet eller cellekjernen og fanges opp av mitokondrielle Ca 2+-depoter.
3. Lavt nivå av klor i cellen.
I cellen i ro er innholdet av klor (8 mmol/l) mer enn 10 ganger lavere enn utenfor cellen (110 mmol/l).
Denne tilstanden opprettholdes ved drift av K + /Cl- -transportøren.
Endringen i den funksjonelle tilstanden til cellen er assosiert (eller forårsaket) med en endring i permeabiliteten til membranen for klor. Ved aktivering av spennings- og ligandstyrte kloridkanaler går ionet inn i cytosolen gjennom kanalen ved passiv transport.
I tillegg dannes klorinngangen i cytosolen av Na+/K+/2CH-kotransportøren og CG-HCO3-veksleren.
Inntreden av klor i cellen øker polariteten til membranen opp til hyperpolarisering.
Funksjoner ved ionetransport spiller en grunnleggende rolle i dannelsen av bioelektriske fenomener i organer og vev som koder for informasjon, bestemmer den funksjonelle tilstanden til disse strukturene, deres overgang fra en funksjonell tilstand til en annen.
For ulike stoffer og spesielt for mineralioner er det ekstremt viktig i cellens liv og spesielt i mekanismene for persepsjon, transformasjon, signaloverføring fra celle til celle og til intracellulære strukturer.
Den avgjørende rollen i tilstanden til permeabilitet av cellemembraner spilles av deres ionekanaler, som dannes kanaldannende proteiner. Åpningen og lukkingen av disse kanalene kan kontrolleres av størrelsen på potensialforskjellen mellom ytre og indre overflater av membranen, en rekke signalmolekyler (hormoner, nevrotransmittere, vasoaktive stoffer), sekundære mediatorer av intracellulær signaloverføring og mineraler. ioner.
ionekanal- flere underenheter (integrerte membranproteiner som inneholder transmembrane segmenter, som hver har en a-helikal konfigurasjon) som sikrer overføring av ioner gjennom membranen.
Ris. 1. Klassifisering av ionekanaler
Moderne ideer om strukturen og funksjonen til ionekanaler har blitt mulig på grunn av utviklingen av metoder for å registrere elektriske strømmer som strømmer gjennom en isolert del av membranen som inneholder enkelt ionekanaler, samt på grunn av isolering og kloning av individuelle gener som kontrollerer syntese av proteinmakromolekyler som er i stand til å danne ionekanaler. Dette gjorde det mulig å kunstig modifisere strukturen til slike molekyler, integrere dem i cellemembraner og studere rollen til individuelle peptidregioner i å utføre kanalfunksjoner. Det viste seg at de kanaldannende proteinmolekylene til alle ionekanaler har noen fellestrekk ved strukturen og vanligvis representert av store transmembrane proteiner med molekylvekter over 250 kDa.
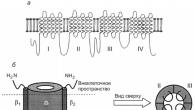
De består av flere underenheter. Vanligvis det viktigste kanalegenskaper bestemt av deres a-underenhet. Denne underenheten er involvert i dannelsen av et ioneselektivt hull, en sensorisk mekanisme for en transmembranpotensialforskjell, en kanalport, og har bindingssteder for eksogene og endogene ligander. Andre underenheter inkludert i strukturen til ionekanaler spiller en hjelperolle, og modulerer egenskapene til kanalene (fig. 2).
Det kanaldannende proteinmolekylet er representert av ekstramembrane aminosyreløkker og intramembranspiraliserte regioner-domener som danner underenheter av ionekanaler. Proteinmolekylet er foldet i membranens plan på en slik måte at selve ionekanalen dannes mellom domenene i kontakt med hverandre (se fig. 2, nederst til høyre).
Det kanaldannende proteinmolekylet er lokalisert i den cytoplasmatiske membranen slik at dens tredimensjonale romlige struktur danner munningen av kanalen som vender mot ytre og indre sider av memoranum, en pore fylt med vann og en "port". Sistnevnte er dannet av en del av peptidkjeden, som lett kan endre konformasjonen og bestemme den åpne eller lukkede tilstanden til kanalen. Selektiviteten og permeabiliteten til ionekanalen avhenger av porestørrelsen og ladningen. Kanalpermeabiliteten for et gitt ion bestemmes også av dets størrelse, ladning og hydreringsskall.

Ris. Fig. 2. Struktur av Na+ ionekanalen til cellemembranen: a — todimensjonal struktur av a-underenheten til ionekanalen til cellemembranen; b — venstre — natriumkanal, bestående av en a-underenhet og to P-underenheter (sidevisning); til høyre — natriumkanalhøygaffelen ovenfra. Nummer I. II. III. IV-merkede domener av a-underenheten
Typer ionekanaler
Mer enn 100 varianter av ionekanaler er beskrevet, for klassifiseringen av disse brukes ulike tilnærminger. En av dem er basert på å ta hensyn til forskjeller i strukturen til kanaler og i funksjonsmekanismene. I dette tilfellet kan ionekanaler deles inn i flere typer:
- passive ionekanaler, eller hvilekanaler;
- gap junction kanaler;
- kanaler, hvis tilstand (åpne eller lukkede) styres av påvirkningen på deres portmekanisme av mekaniske faktorer (mekanosensitive kanaler), potensielle forskjeller på membranen (spenningsstyrte kanaler), eller ligander som binder seg til det kanaldannende proteinet på ytre eller indre side av membranen (ligand-gatede kanaler).
Passive kanaler
Et særtrekk ved disse kanalene er at de kan være åpne (aktive) i hvilende celler; i fravær av noen påvirkning. Dette forhåndsbestemmer deres andre navn - passive kanaler. De er ikke strengt selektive, og cellemembranen kan "flyte" gjennom dem for flere ioner, for eksempel K+ og CI+ K+ og Na+. Derfor kalles disse kanalene noen ganger lekkasjekanaler. På grunn av disse egenskapene spiller hvilekanaler en viktig rolle i fremveksten og vedlikeholdet av hvilemembranpotensialet på cellens cytoplasmatiske membran, hvis mekanismer og betydning er diskutert nedenfor. Passive kanaler er tilstede i de cytoplasmatiske membranene til nervefibre og deres ender, celler i tverrstripete, glatte muskler, myokard og annet vev.
Mekanosensitive kanaler
Tilstanden til permeabiliteten til disse kanalene endres under mekanisk påvirkning på membranen, noe som forårsaker et brudd på den strukturelle pakkingen av molekyler i membranen og dens strekking. Disse kanalene er bredt representert i mekanoreseptorene til blodkar, indre organer, hud, tverrstripete muskler og glatte myocytter.
Potensial-gatede kanaler
Tilstanden til disse kanalene styres av kreftene til det elektriske feltet som skapes av størrelsen på potensialforskjellen over membranen. Potensialavhengige kanaler kan være i inaktive (lukkede), aktive (åpne) og inaktiverte tilstander, som styres av posisjonen til aktiverings- og inaktiveringsportene, avhengig av potensialforskjellen over membranen.
I en hvilecelle er den spenningsstyrte kanalen vanligvis i lukket tilstand, hvorfra den kan åpnes eller aktiveres. Sannsynligheten for selvåpning er lav, og i hvile er bare et lite antall av disse kanalene i membranen åpne. En reduksjon i (membrandepolarisering) forårsaker kanalaktivering, noe som øker sannsynligheten for at den åpner seg. Det antas at funksjonen til aktiveringsporten utføres av en elektrisk ladet aminosyregruppe som lukker inngangen til kanalens munning. Disse aminosyrene er potensialforskjellssensoren over membranen; når et visst (kritisk) nivå av membrandepolarisering er nådd, forskyver den ladede delen av sensormolekylet seg mot lipidmikromiljøet til det kanaldannende molekylet, og porten åpner inngangen til kanalens munning (fig. 3).
Kanalen blir åpen (aktiv) slik at ioner kan bevege seg gjennom den. Åpningshastigheten til aktiveringsporten kan være lav eller veldig høy. I følge denne indikatoren er spenningsstyrte ionekanaler delt inn i raske (for eksempel raske spenningsstyrte natriumkanaler) og langsomme (for eksempel sakte spenningsstyrte kalsiumkanaler). Raske kanaler åpnes umiddelbart (µs) og forblir åpne i gjennomsnittlig 1 ms. Aktiveringen deres er ledsaget av en rask skredlignende økning i permeabiliteten til kanalen for visse ioner.
Evnen til å endre konformasjonen besittes av en annen del av peptidkjeden, som er en aminosyresekvens i form av en tett ball (ball) på en tråd, plassert ved utgangen av en annen munning av kanalen. Når tegnet på ladningen på membranen endres, lukker ballen utgangen fra munnen, kanalen blir ugjennomtrengelig (inaktivert) for ionet. Inaktivering av spenningsstyrte ionekanaler kan utføres ved hjelp av andre mekanismer. Inaktivering er ledsaget av opphør av bevegelsen av ioner gjennom kanalen og kan fortsette like raskt som aktivering, eller sakte - i løpet av sekunder eller til og med minutter.

Ris. 3. Gated mekanisme av spenningsstyrte natrium (øverst) og kalium (bunn) kanaler
For å gjenopprette de opprinnelige egenskapene til ionekanaler etter deres inaktivering, er det nødvendig å returnere den innledende romlige konformasjonen til det kanaldannende proteinet og posisjonen til porten. Dette oppnås ved å gjenopprette potensialforskjellen til membranen (repolarisering) til et nivå som er karakteristisk for cellens hviletilstand eller en tid etter inaktivering med sterk innvirkning på membranen. Overgangen fra inaktiveringstilstand til initial (lukket) tilstand kalles kanalreaktivering. Når ionekanalen reaktiveres, går den tilbake til en tilstand av beredskap for gjenåpning. Reaktiveringen av spenningsstyrte membrankanaler kan også være rask eller sakte.
Potensialstyrte ionekanaler er vanligvis svært selektive og spiller en avgjørende rolle i forekomsten av eksitasjon (generering av aksjonspotensialer), overføring av informasjon langs nervefibre i form av elektriske signaler, og initiering og regulering av muskelkontraksjon. Disse kanalene er bredt representert i membranene til afferente, efferente nervefibre, i membranene til stripete og glatte myocytter.
Potensielt avhengige ionekanaler er bygget inn i membranen til nerveendene til sensoriske nerver (dendritter) som innerverer tannmassen, munnslimhinnen, hvor åpningen deres sikrer omdannelsen av reseptorpotensialet til en nerveimpuls og dens påfølgende ledning langs den afferente nerven. fiber. Ved hjelp av disse impulsene overføres informasjon til sentralnervesystemet om alle typer sansefornemmelser som en person har i munnhulen (smak, temperatur, mekanisk trykk, smerte). Slike kanaler sikrer forekomsten av nerveimpulser på membranen til aksonbakken til nevroner og dens ledning langs efferente nervefibre, konvertering av postsynaptiske potensialer til aksjonspotensialer av postsynaptiske effektorceller. Et eksempel på slike prosesser kan være generering av nerveimpulser i de motoriske nevronene i trigeminuskjernen, som deretter overføres langs dens efferente fibre til tyggemusklene og gir initiering og regulering av tyggebevegelser i underkjeven.
Når du studerte de subtile mekanismene for funksjonen til spenningsstyrte ionekanaler, ble det funnet at det er stoffer som kan blokkere driften av disse kanalene. En av de første blant dem ble beskrevet stoffet tetrodotoxin - den sterkeste giften dannet i kroppen til fugufisk. Under dens handling ble blokkering av spenningsavhengige natriumkanaler observert i eksperimentet, og når det ble introdusert i dyrekroppen, ble tap av følsomhet, muskelavslapping, immobilitet, pustestans og død notert. Slike stoffer kalles ionekanalblokkere. Blant dem lidokain, novokain, prokain stoffer, når de introduseres i kroppen i små doser, utvikles en blokkade av spenningsavhengige natriumkanaler av nervefibre og overføringen av signaler fra smertereseptorer til sentralnervesystemet blokkeres. Disse stoffene er mye brukt i medisinsk praksis som lokalbedøvelse.
Bevegelsen av ioner gjennom ionekanaler er ikke bare grunnlaget for omfordeling av ladninger på membraner og dannelse av elektriske potensialer, men kan også påvirke forløpet av mange intracellulære prosesser. En slik effekt på ekspresjonen av gener som kontrollerer syntesen av kanaldannende proteiner er ikke begrenset til celler i eksiterbare vev, men finner sted i alle celler i kroppen. En stor gruppe sykdommer er identifisert, årsaken til disse er et brudd på strukturen og funksjonen til ionekanaler. Slike sykdommer refereres til gruppen "canalopatier". Åpenbart er kunnskap om strukturen og funksjonene til ionekanaler nødvendig for å forstå naturen til "kanalopatier" og søke etter deres spesifikke terapi.
Ligand-gatede ionekanaler
De er vanligvis dannet av proteinmakromolekyler som samtidig kan fungere som ionekanaler og som reseptor for visse ligander. Siden det samme makromolekylet samtidig kan utføre disse to funksjonene, har forskjellige navn blitt tildelt dem - for eksempel en synaptisk reseptor eller en ligandavhengig kanal.
I motsetning til en spenningsstyrt ionekanal, som åpnes når konformasjonen til aktiveringsporten endres under forhold med en reduksjon i, åpnes (aktiveres) ligandstyrte ionekanaler når peptidkjeden (reseptor) til et proteinmolekyl interagerer med en ligand, et stoff som reseptoren har høy affinitet for (fig. 4).

Ris. 4. Ligandavhengig ionekanal (nikotinfølsom acetylkolinreseptor - n-ChR): en inaktiv; 6 - aktivert
Ligandavhengige ionekanaler er vanligvis lokalisert i de postsynaptiske membranene til nerveceller og deres prosesser, samt muskelfibre. Typiske eksempler på ligand-gatede ionekanaler er postsynaptiske membrankanaler aktivert av acetylkolin (se fig. 4), glutamat, aspartat, gamma-aminosmørsyre, glycin og andre synaptiske nevrotransmittere. Vanligvis gjenspeiler navnet på kanalen (reseptoren) typen nevrotransmitter, som under naturlige forhold er dens ligand. Så hvis dette er kanalene til den nevromuskulære synapsen, der nevrotransmitteren acetylkolin brukes, brukes begrepet "acetylkolinreseptor", og hvis det også er følsomt for nikotin, kalles det den nikotinfølsomme, eller ganske enkelt n-acetylkolin, reseptor (n-kolinerg reseptor).
Vanligvis binder postsynaptiske reseptorer (kanaler) seg selektivt til bare én type nevrotransmitter. Avhengig av typen og egenskapene til den interagerende reseptoren og nevrotransmitteren, endrer kanalene selektivt permeabiliteten for mineralioner, men de er ikke strengt selektive kanaler. For eksempel kan ligand-gatede kanaler endre permeabiliteten for Na+ og K+ kationer, eller for K+ og CI+ anioner. Slik selektivitet av ligandbinding og endringer i ionisk permeabilitet er genetisk fiksert i den romlige strukturen til makromolekylet.
Hvis interaksjonen mellom mediatoren og reseptordelen av makromolekylet som danner ionekanalen er direkte ledsaget av en endring i permeabiliteten til kanalen, fører dette innen noen få millisekunder til en endring i permeabiliteten til den postsynaptiske membranen for mineraler. ioner og verdien av det postsynaptiske potensialet. Slike kanaler kalles raske og er lokalisert, for eksempel i den postsynaptiske membranen til akso-dendritiske eksitatoriske synapser og aksosomatisk hemmende synapser.
Det er langsomme ligand-gatede ionekanaler. I motsetning til raske kanaler, medieres åpningen deres ikke av direkte interaksjon av nevrotransmitteren med reseptormakromolekylet, men av en kjede av hendelser, inkludert aktivering av G-proteinet, dets interaksjon med GTP, en økning i nivået av andre budbringere i den intracellulære signaloverføringen av nevrotransmitteren, som ved fosforylering av ionekanalen fører til en endring i dens permeabilitet for mineralioner og en tilsvarende endring i størrelsen på det postsynaptiske potensialet. Hele den beskrevne hendelseskjeden er allerede utført på hundrevis av millisekunder. Vi vil møte slike langsomme ligandavhengige ionekanaler når vi studerer mekanismene for regulering av arbeidet til hjertet og glatt muskulatur.
En spesiell type er kanaler lokalisert i membranene til det endoplasmatiske retikulumet til en glatt muskelcelle. Liganden deres er et sekundært mellomledd av intracellulær signaltransduksjon inositol-tri-fosfat-IFZ.
Ionekanaler er beskrevet som er preget av noen strukturelle og funksjonelle egenskaper som er iboende i både spenningsstyrte og ligand-gatede ionekanaler. De er spenningsufølsomme ionekanaler, hvis tilstand av portmekanismen styres av sykliske nukleotider (cAMP og cGMP). I dette tilfellet binder sykliske nukleotider seg til den intracellulære COOH-terminalen til det kanaldannende proteinmolekylet og aktiverer kanalen.
Disse kanalene er preget av lavere permeabilitetsselektivitet for kationer og sistnevntes evne til å påvirke hverandres permeabilitet. Dermed blokkerer Ca 2+ -ioner, som kommer gjennom aktiverte kanaler fra det ekstracellulære mediet, permeabiliteten til kanaler for Na 2+ -ioner. Et eksempel på slike kanaler er ionekanalene til retinalstavene, hvis permeabilitet for Ca 2+ og Na 2+ ioner bestemmes av nivået av cGMP.
Ligandavhengige ionekanaler er bredt representert i membranstrukturer som gir synaptisk overføring av signaler fra en rekke sensoriske reseptorer i CNS; signaloverføring i synapsene i nervesystemet; overføring av signaler fra nervesystemet til effektorceller.
Det har allerede blitt bemerket at direkte overføring av kommandoer fra nervesystemet til mange effektororganer utføres ved hjelp av nevrotransmittere som aktiverer ligandavhengige ionekanaler i postsynaptiske membraner. Imidlertid kan deres ligander (agonister eller antagonister) også være stoffer av eksogen natur, som i noen tilfeller brukes som medisinske stoffer.
For eksempel, etter innføring i kroppen av et stoff diplacin, som i struktur ligner nevrotransmitteren apetylkolin, vil det følge en forlenget åpning av ligandavhengige ionekanaler av nevromuskulære synapser, som slutter å overføre nerveimpulser fra nervefibre til muskler. Det kommer en avspenning av skjelettmuskulaturen i kroppen, som kan være nødvendig under komplekse kirurgiske operasjoner. Diplasin og andre stoffer som kan endre tilstanden til ligandavhengige ionekanaler og blokkere signaloverføring i nevromuskulære synapser kalles muskelavslappende midler.

Ris. 5. Sperre overgangskanaler mellom to tett kontaktende celler
I medisinsk praksis brukes mange andre medisinske stoffer som påvirker tilstanden til ligandavhengige ionekanaler i celler i forskjellige vev.
Kanaler av gap (tette) cellekryss
Gap junction-kanaler dannes i kontaktområdet mellom to naboceller som er svært nær hverandre. I membranen til hver kontaktcelle danner seks proteinunderenheter, kalt connexiner, en sekskantet struktur, i midten av hvilken en pore- eller ionekanal, connexon, dannes (fig. 5).
En speilstruktur dannes ved kontaktpunktet i membranen til en nabocelle, og ionekanalen mellom dem blir vanlig. Ulike mineralioner, inkludert Ca 2+ -ioner, så vel som organiske stoffer med lav molekylvekt, kan bevege seg fra celle til celle gjennom slike ionekanaler. Gap junction-kanaler til celler sikrer overføring av informasjon mellom cellene i myokardiet, glatte muskler, netthinnen og nervesystemet.
natriumkanaler
I kroppens celler er spenningsavhengige, spenningsuavhengige (ligandavhengige, mekanosensitive, passive, etc.) natriumkanaler bredt representert.
spenningsstyrte natriumkanaler
De består av én α-subenhet, som danner kanalen, og to β-subenheter, som modulerer ionepermeabilitet og n(fig. 6).

Ris. 6. Todimensjonal struktur av a-underenheten til den spenningsstyrte natriumkanalen. Beskrivelse i tekst
Som det fremgår av fig. 6a-underenhet er representert av fire lignende domener, bestående av seks spiralformede transmembransegmenter forbundet med aminosyreløkker. Sløyfene som forbinder det 5. og 6. segmentet omgir kanalporen, og det 4. segmentet inneholder positivt ladede aminosyrer, som er potensialforskjellssensorer på membranen og kontrollerer posisjonen til portmekanismen under transmembranpotensialskift.
Det er to portmekanismer i spenningsstyrte natriumkanaler, en av dem er aktivering (med deltakelse av det fjerde segmentet) sikrer åpning (aktivering) av kanalen under membrandepolarisering, og den andre (med deltakelse av den intracellulære sløyfen) mellom 3. og 4. domene) - dens inaktivering ved membranopplading. Siden begge disse mekanismene raskt endrer posisjonen til kanalporten, er spenningsstyrte natriumkanaler raske ionekanaler og er av avgjørende betydning for generering av aksjonspotensialer i eksiterbare vev og for deres ledning langs membranene til nerve- og muskelfibre.
Disse kanalene er lokalisert i de cytoplasmatiske membranene til aksonbakken til nevroner, i dendritter og aksoner, i membranen til den perisynaptiske regionen av den nevromuskulære synapsen, i sarkolemmaet til fibrene i de tverrstripete musklene og det kontraktile myokardiet. Fordelingstettheten til natriumkanaler i disse strukturene er forskjellig. I myeliniserte nervefibre er de hovedsakelig konsentrert i området til nodene til Ranvier, der deres tetthet når omtrent 10 000 kanaler per kvadratmikron område, mens i umyelinerte fibre er kanalene mer jevnt fordelt med en tetthet på omtrent 20 kanaler pr. samme område. Disse kanalene er praktisk talt fraværende i strukturen til nervecellens kroppsmembraner, i membranen til nerveender som direkte danner sensoriske reseptorer, og i de postsynaptiske membranene til effektorceller.
Blant spenningsstyrte natriumkanaler er det allerede mer enn ni undertyper som er forskjellige i egenskapene til a-underenheter, som har en viss vevstilknytning og utmerker seg ved forskjellig følsomhet for virkningen av blokkere. For eksempel er en undertype av en kanal dannet av et kanaldannende protein, hvis syntese kontrolleres av SCN4A-genet, i sarcolemmaet til fullt differensierte og innerverte skjelettmuskler, og blokkeringene er tetrodotoksin, saksitoksin og u. -konotoksiner. I de fleste tilfeller er a-underenhetene følsomme for virkningen av tetrodotoksin, som i mikromolare konsentrasjoner blokkerer porene og dermed inngangen til natriumkanalene.
Natriumkanaltoksiner er kjent for å redusere hastigheten på inaktiveringen deres. For eksempel bremser sjøanemontoksin (ATX) og skorpion a-toksin (ScTX) inaktiveringen ved å binde seg til aminosyrerestene i S3-S4-løkken i det fjerde segmentet.
Syntetisert og mye brukt i medisin for blokkering av raske spenningsstyrte natriumkanaler, stoffer som kalles anestetika (novokain, dicaine, lidokain, sovkain, prokain og så videre.). Anestesi når de blokkerer natriumkanaler oppnås ved å eliminere muligheten for å generere nerveimpulser i afferente nervefibre og derved blokkere ledning av signaler fra sensoriske smertereseptorer i sentralnervesystemet.
Det er funnet at endringer i strukturen til natriumkanaler kan føre til utvikling av en rekke sykdommer. For eksempel fører en endring i strukturen til kanalen kontrollert av SCNlb-genet til utvikling av generaliserte former for epilepsi og kramper med økning i kroppstemperatur (feberkramper).
Mange mikroorganismer danner giftstoffer i menneskekroppen - stoffer som blokkerer ionekanaler i de berørte cellene, som kan være ledsaget av et brudd på ionebalansen og celledød. Andre mikroorganismer, tvert imot, danner ionekanaler i cellemembranen med sine giftstoffer (perforiner). Spesielt toksinet fra miltbrannbasillen, som forårsaker en spesielt farlig infeksjon hos mennesker, angriper cellen og danner nye porer (kanaler) i dens membran som andre giftstoffer trenger gjennom cellen. Virkningen av disse giftstoffene skyldes døden av angrepne celler og høy dødelighet i denne sykdommen. Forskere har syntetisert stoffet β-cyklodekstrin, som i romlig struktur ligner formen på den dannede kanalen. Dette stoffet blokkerer kanalene som dannes av giftstoffet til mikroorganismen, hindrer inntrengning av giftstoffer i cellene og redder forsøksdyr infisert med miltbrann fra døden.
Potensielle uavhengige natriumkanaler
Ligand-gatede natriumkanaler. Deres generelle struktur og egenskaper ble diskutert ovenfor når de beskrev ligand-gatede ionekanaler. Denne typen natriumkanaler er bredt representert i kroppen av natriumkanaler av den nikotinfølsomme kolinerge reseptoren i den postsynaptiske membranen til den nevromuskulære synapsen, interneuronale synapser i sentralnervesystemet og det autonome nervesystemet (preganglioniske og ganglioniske nevroner). Ligandavhengige natriumkanaler er lokalisert i de postsynaptiske membranene til andre eksitatoriske (glutamat- og aspartatergiske) CNS-synapser. De spiller en avgjørende rolle i genereringen av eksitatoriske postsynaptiske potensialer i synapser og i overføringen av signaler mellom nevroner og mellom nevroner og effektorceller.
Ligandavhengige natriumkanaler i den postsynaptiske membranen er ikke strengt selektive og kan være permeable samtidig for flere ioner: natrium og kalium, natrium og kalsium.
Potensielle uavhengige natriumkanaler drevet av andre budbringere. Tilstanden til disse natriumkanalene kan kontrolleres av cGMP (fotoreseptorer), cAMP (olfaktoriske reseptorer) og av G-proteinunderenheter (myokard).
mekanosensitive natriumkanaler. Tilstede i mekanoreseptorene til veggene i blodårene, hjertet, hule indre organer, proprioseptorer av tverrstripete muskler, membranen til glatte myocytter. Med deres deltakelse i sensoriske reseptorer omdannes energien til mekanisk handling til en svingning av potensialforskjellen - reseptorpotensialet.
Passive natriumtau. Inneholdt i de cytoplasmatiske membranene til eksitable celler. Permeabiliteten til disse kanalene for Na+-ioner er lav, men gjennom dem diffunderer Na-ioner langs konsentrasjonsgradienten fra de ekstracellulære rommene inn i cellene og depolariserer membranen noe. Natriumkanalene til den cytoplasmatiske membranen til glatte myocytter er mer betydelig permeable for klipping. De depolariserer den i større grad (hvilepotensial på ca. 50 mV) enn membranen til myocytter i tverrstripete muskler (hvilepotensial på ca. 90 mV). Dermed er passive natriumkanaler involvert i dannelsen av hvilemembranpotensialet.
natriumvekslere. Tidligere har natrium-kalsium-utvekslingsmekanismen, eller natrium-kalsium-veksleren, blitt beskrevet, som spiller en viktig rolle i fjerning av kalsiumioner fra kontraktile kardiomyocytter.
Natrium-protonveksler. Det er en spesiell type kanaldannende protein som fjerner hydrogenprotoner fra intracellulære rom i bytte mot at natriumioner trenger inn i cellen. Fjerning av protoner aktiveres ved å senke pH i cellen.
Syntesen av proteiner som danner utvekslingsnatriumkanaler styres av fem gener, som er betegnet som NAH1 -NAH5.
kaliumkanaler
Det er spenningsstyrte og spenningsufølsomme kaliumkanaler. Blant de sistnevnte skilles passive, ligandavhengige og andre typer kaliumkanaler. Som regel finnes kaliumkanaler i membranene til de samme cellene og vevet som inneholder natriumkanaler. En av grunnene til en slik parallellitet i arrangementet av disse ionekanalene er at Na+ og K+ ioner er de viktigste kationene, hvis art av distribusjon og bevegelse bestemmer fremveksten og endringen av elektriske potensialer som en av de viktigste formene for overføring av informasjonssignaler i kroppen.
Det er en hel superfamilie av kaliumionkanaler, som er delt inn i separate familier, typer og undertyper i henhold til kanalenes strukturelle egenskaper, plassering og egenskaper. Mer enn tre dusin kaliumkanaler er beskrevet, og det er ikke mulig å karakterisere dem i detalj. Derfor vil beskrivelser av de familier og typer ionekanaler som primært er relatert til signalveier og kontrollmekanismer for nerve- og muskelprosesser gis som eksempler.
passive kaliumkanaler
Det er kjent at i hvile er membranene til eksitable celler relativt godt permeable for K-ioner og dårlig permeable for Na+-ioner. Siden bærerne av transmembrane elektriske strømmer er ioner, kan man ved å måle den elektriske strømmen som flyter gjennom cellemembranen bedømme tilstanden til ionekanalene. Det viste seg at den transmembrane elektriske strømmen, på grunn av diffusjonen av K-ioner langs konsentrasjonsgradienten fra cellen, er omtrent to pikoampere og har en pulserende karakter, og den gjennomsnittlige varigheten av pulseringen er flere millisekunder. Fra denne observasjonen ble det konkludert med at kaliumkanaler i en hvilende celle spontant kan åpne og lukke, noe som gir betingelser for diffusjon av K-ioner gjennom dem fra cellen og dannelse av et hvilepotensial på membranen.
Spenningsstyrte kaliumkanaler
Eksistensen av spenningsstyrte kaliumkanaler i cellemembraner i eksitable vev ble kjent etter at det ble funnet at deres aktiveringskinetikk er forskjellig fra spenningsstyrte natriumkanaler, og dessuten blokkeres de selektivt av andre blokkere. Kaliumkanaler aktiveres på samme måte som natriumkanaler når cellemembranen depolariseres til et kritisk nivå, men frigjøringshastigheten av K+-ioner fra cellen øker mye saktere enn hastigheten for inntreden av Na+-ioner i cellen.
Det selektive filteret til kaliumkanalen er plassert på innsiden av munningen av poren, i motsetning til den ytre plasseringen av et slikt filter i natriumkanaler (fig. 7). Eksistensen av selektivitet til disse kanalene med hensyn til Na+- og K+-kationer og forskjellige spesifikke blokkere - tetrodotoksin (for natrium) og tetraetylammonium (for kalium) - indikerer den forskjellige strukturen til disse kanalene.
Spenningsstyrte kaliumkanaler er tetramerer og består av fire underenheter som danner en pore i midten.
Spenningsstyrte kaliumkanaler er lokalisert i membranene til både eksiterbare og ikke-eksiterbare celler. De spiller en viktig rolle i gjenopprettingshastigheten (repolarisering) av potensialet på membranen etter dens depolarisering og dermed i å kontrollere formen og frekvensen for generering av aksjonspotensialer. Langsomme kaliumkanaler blokkeres av tri-etylammonium, 4-aminopyridin, fencyklidin, 9-aminoakridin.

Ris. Fig. 7. Kaliumkanal: a — venstre — todimensjonal struktur av a-underenheten; til høyre er kanaldiagrammet; b - elektrondiffraksjonsmønster av kaliumkanaler i cytoplasmatisk membran.
I tillegg til langsomme kaliumkanaler, beskrives raske spenningsstyrte kaliumkanaler, hvis åpningskinetikk ligner på hurtigspenningsstyrte natriumkanaler. Disse kaliumkanalene åpner seg raskt under depolarisering, blir deretter fullstendig inaktivert, og reaktiveringen deres krever ikke bare repolarisering av membranen, men hyperpolarisering av den i noen tid.
I samsvar med navnene på gener som koder for syntesen og sammenstillingen av kanaldannende molekyler, skilles seks KCN-typer med subtyper KCN A, B, C, E og en familie av KCNQ-ionekanaler. Kanalene til sistnevnte familie kommer til uttrykk i myokardiet.
Ligand-gatede kaliumkanaler
De er representert av et stort antall kanaler som er følsomme for virkningen av forskjellige ligander.
En type tallrike ligand-gatede kaliumkanaler er kanaler assosiert med muskarinsensitive acetylkolinreseptorer. Disse kanalene aktiveres av acetylkolin. Kanaler kan blokkeres av bradykinin og bariumioner. Det er to undertyper av disse kanalene: muskarin-inaktivert og muskarin-aktivert. Sistnevnte er lokalisert i cellene til pacemakeren i hjertet.
Egenskapene til en ligandavhengig kaliumkanal besittes av ikke-selektive potensialuavhengige kationkanaler som kombinerer funksjonene til kanaler og nikotinfølsomme acetylkolinreseptorer i den postsynaptiske membranen til den nevromuskulære synapsen. Når det kanaldannende proteinet interagerer med acetylkolin, åpnes denne ikke-selektive kanalen, gjennom hvilken Na + -ioner kommer inn i muskelcellen, og K-ioner forlater den. Den forskjellige bevegelseshastigheten til disse ionene sikrer forekomsten av depolarisering av den postsynaptiske membranen, som ikke utvikler seg til et aksjonspotensial direkte på denne membranen.
Det er identifisert ATP-sensitive kaliumkanaler som hemmes og aktiveres av virkningen av ATP.
En egen familie av kaliumkanaler er de såkalte inngangslikrikterne (ventiler), eller inngangslikerettere. (framoverutbedring; framoverlikeretter). Det er ingen spenningssensor i portmekanismen til de likerettede kaliumkanalene. Den funksjonelle betydningen av disse kanalene ligger i deres effekt på eksitabiliteten til pacemakerceller, muskelceller og nevroner.
Familien av likeretterinngangskaliumkanaler, i samsvar med navnene på genene som koder for dem, er delt inn i mer enn 15 typer. Et eksempel på den spesifikke betydningen av de korrigerende inngangs-kaliumkanalene og spesielt KCNJ-kanalene 3, 5, 6 og 9 (en annen betegnelse Kir-kanaler) kan være deres spesifikke rolle i reguleringen av hjertefrekvensen gjennom assosiasjonen av disse kanalene med G-protein og muskarinsensitive acetylkolinreseptorer av celler - pacemakere i hjertet.
Spenningsufølsomme natriumaktiverte kaliumkanaler er kjent.
Spesifikke potensielt ufølsomme kaliumkanaler er beskrevet som er følsomme for endringer i pH, som er tilstede i p-celler på bukspyttkjerteløyer og fungerer som en glukosesensor i dem. Også kjent er kaliumkanaler som er følsomme for endringer i cellevolum.
kalsiumkanaler
Familien av kalsiumkanaler er bredt representert i cellene i nerve- og muskelvevet. Hovedstedene for deres lokalisering er membranene til de presynaptiske terminalene til det sarkoplasmatiske og endoplasmatiske retikulumet til muskler, sarcolemmaet til kardiomyocytter og membranene til celler i andre vev.
Kalsiumkanaler er delt inn i spenningsavhengige, passive, ligandavhengige, mekanosensitive, etc., i henhold til metodene for permeabilitetskontroll.
Kalsiumkanaler er delt inn i T-type kanaler i henhold til inaktiveringshastigheten ( flyktig- forbigående), L-type (sakte). Avhengig av vevstilhørighet og følsomhet for virkningen av giftstoffer, isoleres B-type kanaler (hjerne– hjerne), N-type (nevronal- neuronal), P-type (Purkinjecelle- Purkinje-celle) og R-type (resistent mot giftstoffer).
spenningsstyrte kalsiumkanaler
De er dannet av et oligomert protein, vanligvis bestående av fem underenheter a1, a2, β, y og δ. Selve ionekanalen dannes av a-underenheten, som har en høy grad av likhet i aminosyresammensetning og struktur med den analoge underenheten av spenningsstyrte natrium- og kaliumkanaler (se fig. 6, fig. 7).
Den spenningsstyrte kalsiumkanalen har en selektiv permeabilitet for Ca 2+ -ioner. Selektivitet sikres ved tilstedeværelsen av en pore som danner et selektivt filter.
Det er på tide Den er dannet av segmenter av α 1-underenheten; derfor, gitt likheten i strukturen med den for kanaler av monovalente kationer, ville man forvente at kalsiumkanalen skulle være permeabel for Na+ og K+ ioner. Denne egenskapen finner faktisk sted når kalsium elimineres fra det ekstracellulære miljøet.
Under naturlige forhold sikres kalsiumselektivitet i kanalen ved tilstedeværelse av to kalsiumbindingssteder i kanalporen. En av dem er dannet av en gruppe glutamatrester, og ved lav kalsiumkonsentrasjon er den sterkt assosiert med dette stedet av kanalporen, og kalsiumkanalen blir dårlig permeabel. Med en økning i kalsiumkonsentrasjon øker sannsynligheten for at kalsium opptar et andre bindingssted; de resulterende kreftene ved elektrostatisk frastøtning mellom Ca 2+ -ioner reduserer i stor grad oppholdstiden til ionene ved bindingsstedene. Det frigjorte kalsiumet diffunderer gjennom den aktiverte kanalen inn i cellen langs en elektrokjemisk gradient.
Potensialstyrte kalsiumkanaler er forskjellige i terskelverdiene for potensielle differanseskift der de aktiveres. T-type kanaler aktiveres av små spenningsskifter på membranen, L- og P-type kanaler er preget av høye spenningsskiftterskler som forårsaker aktivering av dem.
Potensialstyrte kalsiumkanaler spiller en viktig rolle i en rekke vitale prosesser i kroppen. Deres aktivering og inntreden av kalsium i den presynaptiske terminalen er avgjørende for synaptisk signalering.
Inntreden av kalsium gjennom kalsiumkanaler inn i pacemakercellen er nødvendig for å generere aksjonspotensialer i pacemakercellene i hjertet og sikre dens rytmiske sammentrekning. Potensialavhengige kalsiumkanaler regulerer inntreden av kalsium i sarkoplasmaet til myokardfibre, skjelettmuskler, glatte myocytter i blodkar og indre organer, kontrollerer initieringen, hastigheten, styrken, varigheten av deres sammentrekning og dermed bevegelsen, pumpefunksjonen til hjerte, blodtrykk, respirasjon og mange andre prosesser i kroppen.
passive kalsiumkanaler
De er tilstede i de cytoplasmatiske membranene til glatte myocytter. De er permeable for kalsium i hvile, og kalsium, sammen med K+- og Na+-ioner, er involvert i å skape en transmembranpotensialforskjell eller hvilepotensial for glatte myocytter. Kalsium som kommer inn i den glatte myocytten gjennom disse kanalene er en kilde til påfyll av reservene i det endoplasmatiske retikulumet og brukes som en sekundær budbringer i overføringen av intracellulære signaler.
Kalsium i hvile kan bevege seg fra celle til celle gjennom gap junction-kanaler. Disse kanalene er ikke selektive for kalsium, og intercellulær utveksling av andre ioner og organiske stoffer med liten molekylvekt kan utføres samtidig gjennom dem. Kalsium som kommer inn i cellene gjennom gap junction-kanaler spiller en viktig rolle i forekomsten av eksitasjon, initiering og synkronisering av sammentrekninger av myokard, livmor, sphincter av indre organer, og opprettholdelse av vaskulær tonus.
Ligand-gatede kalsiumkanaler
Når man studerte mekanismene for utløsning og regulering av myokardiale og glatte muskelkontraksjoner, viste det seg at de er avhengige av at kalsium kommer inn i myocytten både fra det ekstracellulære miljøet og fra dets intracellulære lagre. Samtidig kan inntreden av kalsium i sarkoplasmaet styres av en endring i potensialforskjellen over sarkolemmaet og aktivering av spenningsavhengige kalsiumkanaler og (eller) virkningen av en rekke signalmolekyler på membranen til det sarkoplasmatiske retikulum.
Ligandavhengige kalsiumkanaler er lokalisert i de cytoplasmatiske membranene til glatte myocytter. Hormoner kan fungere som ligander av deres reseptorer: vasopressin, oksytocin, adrenalin; nevrotransmitteren noradrenalin; signalmolekyler: angiotensin 2, endotel 1 og andre stoffer. Bindingen av liganden til reseptoren er ledsaget av aktivering av kalsiumkanalen og inntreden av kalsium inn i cellen fra det ekstracellulære mediet.
I kardiomyocytter, for å starte muskelkontraksjon, er det nødvendig å aktivere spenningsavhengige kalsiumkanaler av T-typen, deretter L-typen, hvis åpning sikrer at en viss mengde Ca 2+ -ioner kommer inn i cellen. Kalsium som kommer inn i cellen aktiverer ryanodinreseptoren (RYR), et kanaldannende protein innebygd i membranen til det sarkoplasmatiske retikulumet til kardiomyocytten. Som et resultat av kanalaktivering øker dens permeabilitet for kalsium, og sistnevnte diffunderer inn i sarkoplasmaet langs konsentrasjonsgradienten. Dermed fungerer Ca 2+ ioner som en slags ligand som aktiverer ryanodinreseptorer og dermed kalsiumkanaler. Som et resultat fungerer ekstracellulært kalsium som kommer inn i cellen som en trigger for frigjøring av kalsium fra dens viktigste intracellulære lagring.
Kalsiumkanaler kan samtidig være følsomme for endringer i potensialforskjellen over den cytoplasmatiske membranen og for virkningen av ligander. For eksempel er spenningsstyrte kalsiumkanaler av L-type følsomme for dihydropyridin (nifedipin), fenylalkylaminer (verapamil) og benzotiazepiner (diltiazem). Denne typen kanaler blir ofte referert til som dihydropyridinreseptorer. Dette navnet antyder at L-kalsium-kanalen er ligand-gate, selv om det i virkeligheten er en spennings-gated kanal.
P-type kanaler er motstandsdyktige mot virkningen av konogoksiner og medikamenter, som andre typer kalsiumkanaler er følsomme for.
De funksjonelle egenskapene til a1,-underenheter av spenningsstyrte kalsiumkanaler kan moduleres under deres fosforylering, og dermed kan tilstanden til ionepermeabiliteten til kalsiumkanaler, for eksempel i myokardiet, reguleres.
En spesiell type ligandavhengige kalsiumionekanaler er kanaler lokalisert i membranene til det endoplasmatiske retikulumet til en glatt muskelcelle, hvis permeabilitet kontrolleres av det intracellulære nivået til den andre budbringeren, IGF. Ved å bruke disse kanalene som et eksempel, møter vi tilfellet når et ekstracellulært signaleringsagonistmolekyl, ved å aktivere reseptoren til plasmamembranen til den glatte muskelcellen, slår på inositolfosfatbanen for intracellulær signaltransduksjon, som igjen, gjennom virkning av IGF, går til aktivering av det neste kanaldannende proteinet i membranen til celleorganellen. Hele denne kjeden av signaltransduksjonshendelser ender med frigjøring av Ca 2+ -ioner fra det intracellulære depotet, som utløser og kontrollerer den molekylære mekanismen for sammentrekning av glatte muskelceller.
Mekanosensitive kalsiumkanaler
Lokalisert i plasmamembranen til glatte myocytter i vaskulærveggen, myoitt av indre organer, vaskulært endotel, bronkial epitel. Disse kanalene kan være assosiert med glykoproteinmekanoreseptorer. Som svar på mekanisk påvirkning (for eksempel strekking av karveggen ved blodtrykk), øker permeabiliteten for Ca 2+ -ioner. Mekanosensitive kanaler har ikke høy selektivitet og endrer deres permeabilitet samtidig for en rekke kationer. Inntreden av kalsium og natrium i en glatt muskelcelle forårsaker depolarisering av dens membran, åpning av spenningsavhengige kalsiumkanaler, en økning i kalsiuminntrengning og en sammentrekning av en glatt myocytt.
Disse hendelsene utgjør en del av mekanismen for tilpasning av vaskulær tonus og regulering av blodstrømmen til endrede verdier av blodtrykk i karet og blodstrømningshastighet (myogen regulering). I tillegg er mekanosensitive kalsiumkanaler involvert i implementeringen av mekanismene for vaskulær stressavslapning under en langsiktig økning i blodtrykket.
Klorkanaler
Klorkanaler finnes i plasmamembranene til de fleste celler. De spiller en viktig rolle i å opprettholde en transmembranpotensialforskjell i en hvilende celle og i deres skift når den funksjonelle aktiviteten til cellene endres. Klorkanaler er involvert i reguleringen av cellevolum, transepiteltransport av stoffer og væskesekresjon av sekretoriske celler.
Tre superfamilier av kloridkanaler skilles ut i henhold til aktiveringsmekanismer: spenningsstyrte, ligand-styrte og andre spenningsufølsomme kloridkanaler.
Potensielt avhengige kloridkanaler. Lokalisert i membranene til eksitable celler og epitelceller. Permeabiliteten til disse kanalene styres av størrelsen på.
Potensiell avhengig permeabilitet av kloridkanaler er ikke den samme i forskjellige vev. I aksonmembranen er avhengigheten av permeabiliteten til kloridkanaler på potensialforskjellen ubetydelig og påvirker ikke signifikant endringen i størrelsen på aksjonspotensialet under eksitasjon, mens i skjelettmuskulaturen er denne avhengigheten av permeabiliteten til kloridkanaler. er høyere.
CLC1-kanalen er en typisk representant for kloridkanalene i skjelettmuskelfiber-sarcolemma. Kanalen viser permeabilitet over hele området av transmembranspenningsendringer i hvile, aktiveres ved depolarisering og inaktiveres ved membranhyperpolarisering.
Ligand-gatede kloridkanaler. De kommer hovedsakelig til uttrykk i nervevev. Tilstanden til permeabiliteten til disse kanalene for klor styres primært av ekstracellulære ligander, men de kan være følsomme for intracellulær kalsiumkonsentrasjon, aktivert av G-proteiner og cAMP. Kanaler av denne typen er vidt distribuert i postsynaptiske membraner og brukes til postsynaptisk hemming. Kanalpermeabiliteten kontrolleres ved å aktivere kanalene med hemmende nevrotransmitterligander (y-aminosmørsyre og glycin).
Potensielt ufølsomme kloridkanaler. Inkluderer passive kloridkanaler, ATP-følende kanaler og transmembranregulator for interstitiell fibrosekonduktans (cystiskfibrosetransmembrankonduktansregulator— CFTR).
CFTR består tilsynelatende av selve kloridkanalen og kanalregulatoren, representert av et spesielt regulatorisk domene (P-domene). Ionekonduktansen til disse kanalene reguleres av fosforylering av det regulatoriske domenet av cAMP-avhengig proteinkinase. Brudd på strukturen og funksjonen til denne kanalen fører til utvikling av en alvorlig sykdom, ledsaget av dysfunksjon av mange vev - interstitiell fibrose.
Akvaporiner
Akvaporiner(fra lat. aqua- vann, gresk porus- kanal, tid) - proteiner som danner vannkanaler og gir transmembran vannoverføring. Akvaporiner er integrerte, tetramere membranproteiner, hvis monomer har en masse på omtrent 30 kDa. Dermed danner hver aquaporin fire vannkanaler (fig. 8).
Et trekk ved disse kanalene er at vannmolekyler kan bevege seg i dem under iso-osmotiske forhold, dvs. når ingen osmotiske gradientkrefter virker på dem. Aquaporiner er forkortet til AQP. En rekke typer akvaporiner er blitt isolert og beskrevet: AQP1 — i epitelmembranene til de proksimale nyretubuli, den nedadgående delen av løkken til Henle; i membranene til endotelet og glatte myocytter av blodkar, i strukturene til glasslegemet; AQP2 - i membranene til epitelet til samlekanalene. Dette aquaporin viste seg å være følsomt for virkningen av antidiuretisk hormon, og på dette grunnlag kan det betraktes som en ligandavhengig vannkanal. Uttrykk av genet som kontrollerer syntesen av dette aquaporinet reguleres av antidiuretisk hormon; AQP3 finnes i cellemembraner i øyets hornhinne; AQP4 er i hjerneceller.

Ris. Fig. 8. Struktur av AQP1-vannkanalen: a — peptidkjeder som danner kanalen; b - kanal i sammensatt form: A, B, C, D, E - deler av proteinkjeden
Det viste seg at AQP1 og AQP4 spiller en viktig rolle i dannelsen og sirkulasjonen av cerebrospinalvæske. Akvaporiner finnes i epitelet i mage-tarmkanalen: AQP4 - i magen og tynntarmen; AQP5 - i spyttkjertlene; AQP6 - i tynntarmen og bukspyttkjertelen; AQP7 - i tynntarmen; AQP8, AQP9 - i leveren. Noen aquaporiner transporterer ikke bare vannmolekyler, men også organiske stoffer som er løselige i det (oksygen, glyserol, urea). Dermed spiller aquaporiner en viktig rolle i kroppens vannmetabolisme, og et brudd på funksjonen deres kan være en av årsakene til dannelsen av hjerne- og lungeødem og utviklingen av nyre- og hjertesvikt.
Kunnskap om mekanismene for ionetransport gjennom membraner og metoder for å påvirke denne transporten er en uunnværlig betingelse ikke bare for å forstå mekanismene for regulering av vitale funksjoner, men også for riktig valg av medikamenter i behandlingen av et stort antall sykdommer (hypertensjon). bronkial astma, hjertearytmier, vann-saltforstyrrelser), utveksling, etc.).
For å forstå mekanismene for regulering av fysiologiske prosesser i kroppen, er det nødvendig å vite ikke bare strukturen og permeabiliteten til cellemembraner for forskjellige stoffer, men også strukturen og permeabiliteten til mer komplekse strukturelle formasjoner som ligger mellom blodet og vevet til forskjellige organer.
12. Ionekanaler...
Ionekanalen består av flere underenheter, deres antall i en enkelt ionekanal varierer fra 3 til 12 underenheter. Ved sin organisasjon kan underenhetene som er inkludert i kanalen være homologe (av samme type), et antall kanaler dannes av underenheter av forskjellige typer.
Hver av underenhetene består av flere (tre eller flere) transmembransegmenter (ikke-polare deler vridd i α-helikser), av ekstra- og intracellulære løkker og terminalseksjoner av domener (representert av polare områder av molekyler som danner et domene og stikker ut utover bilipidlaget av membranen).
Hvert av transmembransegmentene, ekstra- og intracellulære løkker og terminale seksjoner av domener utfører sin egen funksjon.
Dermed bestemmer transmembransegmentet 2, organisert i form av en a-helix, selektiviteten til kanalen.
De terminale områdene i domenet fungerer som sensorer for ekstra- og intracellulære ligander, og et av transmembransegmentene spiller rollen som en spenningsavhengig sensor.
De tredje transmembransegmentene i underenheten er ansvarlige for driften av portalkanalsystemet, etc.
Ionekanaler fungerer ved hjelp av mekanismen for tilrettelagt diffusjon. Når kanalene aktiveres, følger bevegelsen av ioner langs dem en konsentrasjonsgradient. Bevegelseshastigheten gjennom membranen er 10 ioner per sekund.
Spesifisitet av ionekanaler.
De fleste av dem er selektive, dvs. kanaler som lar bare én type ion passere (natriumkanaler, kaliumkanaler, kalsiumkanaler, anionkanaler).
kanalselektivitet.
Kanalselektivitet bestemmes av tilstedeværelsen av et selektivt filter.
Dens rolle spilles av den første delen av kanalen, som har en viss ladning, konfigurasjon og størrelse (diameter), som lar bare en viss type ioner passere inn i kanalen.
Noen av ionekanalene er ikke-selektive, for eksempel "lekkasjekanaler". Dette er membrankanaler som i hvile, langs konsentrasjonsgradienten, K + -ioner forlater cellen, men gjennom disse kanalene kommer en liten mengde Na + -ioner også inn i cellen i ro langs konsentrasjonsgradienten.
Ionekanalsensor.
Ionekanalsensoren er en følsom del av kanalen som oppfatter signaler, hvis natur kan være forskjellig.
På dette grunnlaget er det:
spenningsstyrte ionekanaler;
reseptor-gatede ionekanaler;
ligandkontrollert (ligandavhengig);
mekanisk styrt (mekanisk avhengig).
Kanaler som har en sensor kalles kontrollerte. Noen kanaler har ikke sensor. Slike kanaler kalles uadministrerte.
Portsystemet til ionekanalen.
Kanalen har en port som er lukket i hvile og åpnes når et signal påføres. I noen kanaler skilles det mellom to typer porter: aktivering (m-porter) og inaktivering (h-porter).
Det er tre tilstander av ionekanaler:
en hviletilstand når porten er lukket og kanalen er utilgjengelig for ioner;
aktiveringstilstanden, når portsystemet er åpent og ioner beveger seg gjennom membranen langs kanalen;
inaktiveringstilstanden, når kanalen er lukket og ikke reagerer på stimuli.
Ledningshastighet (konduktivitet).
Det er raske og langsomme kanaler. Lekkasjekanaler er langsomme, natriumkanaler i nevroner er raske.
I membranen til enhver celle er det et stort sett med forskjellige (i form av hastighet) ionekanaler, hvis aktivering bestemmer den funksjonelle tilstanden til cellene.
spenningsstyrte kanaler.
Potensielt kontrollert kanal består av:
selektivt filter;
aktiverings- og inaktiveringsporter;
spenningssensor.
porer fylt med vann;
Kanaldiameteren er mye større enn ionediameteren; i den selektive filtersonen smalner den til atomstørrelser, noe som sikrer at denne delen av kanalen utfører funksjonen til et selektivt filter.
Åpning og lukking av portmekanismen skjer når membranpotensialet endres, og porten åpner ved en verdi av membranpotensialet, og lukker på et annet nivå av membranpotensialet.
Det antas at endringen i det elektriske feltet til membranen oppfattes av en spesiell del av kanalveggen, som kalles spenningssensoren.
En endring i tilstanden, på grunn av en endring i nivået av membranpotensialet, forårsaker konformasjonen av proteinmolekylene som danner kanalen, og fører som et resultat til åpning eller lukking av porten til ionekanalen.
Kanaler (natrium, kalsium, kalium) har fire homologe domener - underenheter (I, II, III, IV). Domenet (for eksempel natriumkanaler) består av seks transmembrane segmenter organisert i form av a-helikser, som hver spiller sin egen rolle.
Dermed spiller transmembransegmentet 5 rollen som en pore, transmembransegmentet 4 er en sensor som reagerer på endringer i membranpotensialet, og andre transmembransegmenter er ansvarlige for aktivering og inaktivering av portalkanalsystemet. Inntil slutten har ikke rollen til individuelle transmembrane segmenter og underenheter blitt studert.
Natriumkanaler (innvendig diameter 0,55 nm) er tilstede i cellene i eksiterbare vev. Tetthet per 1 µm 2 i forskjellige vev er ikke det samme.
Så i ikke-myeliniserte nervefibre er det 50-200 kanaler, og i myeliniserte nervefibre (Ranvier intercepts) - 13 000 per 1 mikron 2 membranområde. Ved hvile er de stengt. Membranpotensialet er 70-80 mV.
Eksponering for en stimulus endrer membranpotensialet og aktiverer en spenningsstyrt natriumkanal.
Den aktiveres når membranpotensialet skifter fra hvilepotensialnivået mot det kritiske nivået av depolarisering.
En sterk natriumstrøm gir et skifte i membranpotensialet til et kritisk nivå av depolarisering (CDL).
Endring i membranpotensial opp til -50-40 mV, dvs. til nivået av et kritisk nivå av depolarisering, forårsaker åpning av andre spenningsavhengige Na +-kanaler, gjennom hvilke den innkommende natriumstrømmen utføres, som danner "toppen" av aksjonspotensialet.
Natriumioner beveger seg inn i cellen langs konsentrasjonsgradienten og den kjemiske gradienten gjennom kanalen, og danner den såkalte innkommende natriumstrømmen, som fører til videre rask utvikling av depolarisasjonsprosessen.
Membranpotensial endrer fortegn til motsatt +10-20 mV. Et positivt membranpotensial fører til at natriumkanaler lukkes og inaktiveres.
Potensialavhengige Na+-kanaler spiller en ledende rolle i dannelsen av aksjonspotensialet, dvs. eksitasjonsprosessen i cellen.
Kalsiumioner hindrer åpningen av spenningsstyrte natriumkanaler ved å endre responsparametrene.
TIL + -kanaler
Kaliumkanaler (indre diameter 0,30 nm) er tilstede i cytoplasmatiske membraner, et betydelig antall kanaler for kalium "lekkasje" fra cellen ble funnet.
I hvile er de åpne. Gjennom dem, i hvile, "lekker" kalium fra cellen langs konsentrasjonsgradienten og den elektrokjemiske gradienten.
Denne prosessen omtales som den utgående kaliumstrømmen, som fører til dannelsen av et membranhvilepotensial (-70-80 mV). Disse kaliumkanalene kan kun betinget klassifiseres som spenningsavhengige.
Når membranpotensialet endres under depolarisering, inaktiveres kaliumstrømmen.
Under repolarisering dannes en innkommende K + strøm gjennom spenningsavhengige kanaler, som kalles K + strøm for forsinket likeretting.
En annen type spenningsstyrte K+-kanaler. En rask utadgående kaliumstrøm oppstår langs dem i underterskelområdet til membranpotensialet (positivt sporpotensial). Kanalinaktivering oppstår på grunn av sporhyperpolarisering.
En annen type spenningsstyrte kaliumkanaler aktiveres først etter foreløpig hyperpolarisering, den danner en rask forbigående kaliumstrøm, som raskt inaktiveres.
Kalsiumioner letter åpningen av spenningsstyrte kaliumkanaler ved å endre responsparametrene.
Sa + -kanaler.
Potensial-gatede kanaler gir et betydelig bidrag både til regulering av kalsiuminntrengning i cytoplasma og til elektrogenese.
Proteiner som danner kalsiumkanaler består av fem underenheter (al, a2, b, g, d).
Hovedunderenheten danner selve kanalen og inneholder bindingsseter for ulike kalsiumkanalmodulatorer.
Flere strukturelt distinkte kalsiumkanal-al-underenheter er funnet i pattedyrs nerveceller (betegnet A, B, C, D og E).
Funksjonelt skiller forskjellige typer kalsiumkanaler seg fra hverandre i aktivering, kinetikk, enkeltkanals konduktans og farmakologi.
Opptil seks typer spenningsstyrte kalsiumkanaler er beskrevet i celler (T-, L-, N-, P-, Q-, R-kanaler).
Aktiviteten til spenningsstyrte plasmamembrankanaler reguleres av forskjellige intracellulære sekundære budbringere og membranbundne G-proteiner.
Kalsiumspenningsstyrte kanaler finnes i stort antall i cytoplasmatiske membraner til nevroner, myocytter av glatte, tverrstripete og hjertemuskler, og i membranene i det endoplasmatiske retikulum.
Ca 2+ -kanaler av SPR er oligomere proteiner innebygd i SPR-membranen.
Sa 2+ - kontrollert Sa 2+ - SPR-kanaler.
Disse kalsiumkanalene ble først isolert fra skjelett- og hjertemuskler.
Det viste seg at Ca 2+ -kanaler av SPR i disse muskelvevet har molekylære forskjeller og er kodet av forskjellige gener.
Ca 2+ -kanaler av SPR i hjertemuskulaturen er direkte forbundet med høyterskel Ca 2+ -kanaler i plasmamembranen (L-type) gjennom kalsiumbindende proteiner, og danner dermed en funksjonelt aktiv struktur - en "triade".
I skjelettmuskulaturen aktiverer plasmalemma-depolarisering direkte frigjøringen av Ca 2+ fra det endoplasmatiske retikulumet på grunn av det faktum at Ca 2+-kanalene i plasmamembranen fungerer som spenningsfølsomme sendere av aktiveringssignalet direkte til Ca 2+-kanalene til SPR gjennom binding av proteiner.
Ca 2+ -depoter av skjelettmuskulatur har således en depolarisasjonsindusert Ca 2+ frigjøringsmekanisme (RyRl-type).
I motsetning til skjelettmuskulaturen er endoplasmatiske Ca 2+ kanaler av kardiomyocytter ikke assosiert med plasmamembranen, og stimulering av Ca 2+ frigjøring fra depotet krever en økning i konsentrasjonen av cytosolisk kalsium (RyR2 type).
I tillegg til disse to typene Ca 2+ -aktiverte Ca 2h-kanaler, er det nylig identifisert en tredje type Ca 2+ SPR-kanaler (RyR3-type), som ennå ikke er tilstrekkelig studert.
Alle kalsiumkanaler er preget av langsom aktivering og langsom inaktivering sammenlignet med natriumkanaler.
Når muskelcellen er depolarisert (fremspring av de cytoplasmatiske membranene - T-tubuli nærmer seg membranene i det endoplasmatiske retikulum), oppstår en spenningsavhengig åpning av kalsiumkanalene til membranene til det sarkoplasmatiske retikulum.
Siden på den ene siden er kalsiumkonsentrasjonen i SPR høy (kalsiumdepot), og kalsiumkonsentrasjonen i cytoplasmaet er lav, og på den annen side området til SPR-membranen og tettheten av kalsium kanalene i den er store, kalsiumnivået i cytoplasmaet øker 100 ganger.
Denne økningen i kalsiumkonsentrasjon initierer prosessen med sammentrekning av myofibriller.
Kalsiumkanaler i kardiomyocytter er lokalisert i den cytoplasmatiske membranen og er L-type kalsiumkanaler.
De aktiveres ved et membranpotensial på +20-40 mV, danner en innkommende kalsiumstrøm. De er i aktivert tilstand i lang tid, danner et "platå" av kardiomyocyttaksjonspotensialet.
anionkanaler.
Det største antallet kanaler for klor i cellemembranen. Det er færre kloridioner i cellen sammenlignet med det intercellulære miljøet. Derfor, når kanalene åpner seg, kommer klor inn i cellen langs konsentrasjonsgradienten og den elektrokjemiske gradienten.
Antall kanaler for HCO 3 er ikke så stort, volumet av transport av dette anion gjennom kanalene er mye mindre.
ionebyttere.
Membranen inneholder ionebyttere (bærerproteiner) som utfører tilrettelagt diffusjon av ioner, d.v.s. akselerert koblet bevegelse av ioner gjennom biomembranen langs konsentrasjonsgradienten, slike prosesser er ATP-uavhengige.
De mest kjente er Na + -H +, K + -H +, Ca 2+ -H + vekslere, samt vekslere som gir utveksling av kationer for anioner Na + -HCO- 3, 2CI-Ca 2+ og vekslere som sørge for utveksling av kation for kation (Na + -Ca 2+) eller anion per anion (Cl- HCO3).
Reseptor-gatede ionekanaler.
Ligand-gatede (ligand-gatede) ionekanaler.
Ligand-gatede ionekanaler er en underart av reseptor-gatede kanaler og er alltid kombinert med en reseptor for et biologisk aktivt stoff (BAS).
Reseptorene til de betraktede kanalene tilhører den ionotrope typen membranreseptorer, når de interagerer med biologisk aktive stoffer (ligander), oppstår det raske reaksjoner.
En ligand-gated ionekanal består av:
porer fylt med vann;
selektivt filter;
aktivering gate;
ligandbindingssete (reseptor). Høyenergiaktiv BAS har en høy
affinitet (affinitet) for en bestemt type reseptor. Når ionekanaler aktiveres, beveger visse ioner seg langs en konsentrasjonsgradient og en elektrokjemisk gradient.
I en membranreseptor kan ligandbindingsstedet være tilgjengelig for liganden fra den ytre overflaten av membranen.
I dette tilfellet fungerer hormoner og parahormoner, ioner som en ligand.
Så når N-kolinerge reseptorer aktiveres, aktiveres natriumkanaler.
Kalsiumpermeabilitet initieres av nevronale acetylkolin-gatede, glutamat-gatede (NMDA og AMPA/kainattyper) reseptorer og purinreseptorer.
GABAA-reseptorer er koblet til ioniske kloridkanaler, og glycinreseptorer er også koblet til kloridkanaler.
I en membranreseptor kan ligandbindingssetet være tilgjengelig for ligander fra den indre overflaten av membranen.
I dette tilfellet fungerer proteinkinaser aktivert av andre budbringere eller andre budbringere selv som ligander.
Så proteinkinaser A, C, G, ved fosforylering av kationkanalproteiner, endrer deres permeabilitet.
Mekanisk styrte ionekanaler.
Mekanisk kontrollerte ionekanaler endrer deres ledningsevne for ioner enten ved å endre spenningen i bilipidlaget eller gjennom cellecytoskjelettet. Mange mekanisk kontrollerte kanaler er assosiert med mekanoreseptorer; de finnes i auditive celler, muskelspindler og vaskulært endotel.
Alle mekanisk styrte kanaler er delt inn i to grupper:
strekkaktiverte celler (SAC);
strekk-inaktiverte celler (SIC).
Mekanisk styrte kanaler har alle hovedkanalfunksjonene:
pore fylt med vann;
gate mekanisme;
strekksensor.
Når kanalen er aktivert, beveger ioner seg langs konsentrasjonsgradienten langs den.
Natrium, kalium ATPase.
Natrium, kalium ATPase (natrium-kalium pumpe, natrium-kalium pumpe).
Består av fire transmembrane domener: to α-subenheter og to β-subenheter. α-underenheten er et stort domene og β-underenheten er et lite. Under ionetransport blir store underenheter fosforylert og ioner beveger seg gjennom dem.
Natrium, kalium ATPase spiller en avgjørende rolle for å opprettholde natrium- og kaliumhomeostase i det intra- og ekstracellulære miljøet:
opprettholder et høyt nivå av K + og et lavt nivå av Na + i cellen;
deltar i dannelsen av hvilemembranpotensialet, i genereringen av aksjonspotensialet;
gir Na + konjugert transport av de fleste organiske stoffer gjennom membranen (sekundær aktiv transport);
påvirker homeostasen til H 2 O betydelig.
Natrium, kalium ATPase, gir det viktigste bidraget til dannelsen av ioneasymmetri i ekstra- og intracellulære rom.
Det fasede arbeidet til natrium- og kaliumpumpen gir en ikke-ekvivalent utveksling av kalium og natrium over membranen.
Sa + -ATPase (pumpe).
Det er to familier av Ca 2+ pumper som er ansvarlige for eliminering av Ca 2+ ioner fra cytoplasmaet: Ca 2+ pumpene til plasmamembranen og Ca 2+ pumpene i det endoplasmatiske retikulum.
Selv om de tilhører samme familie av proteiner (den såkalte P-klassen av ATPaser), viser disse pumpene noen forskjeller i struktur, funksjonell aktivitet og farmakologi.
Det finnes i store mengder i den cytoplasmatiske membranen. I cytoplasmaet til cellen i hvile er kalsiumkonsentrasjonen 10-7 mol/l, og utenfor cellen er den mye mer -10-3 mol/l.
En slik signifikant forskjell i konsentrasjoner opprettholdes på grunn av arbeidet til den cytoplasmatiske Ca++ -ATPasen.
Aktiviteten til Ca 2+ -pumpen til plasmamembranen styres direkte av Ca 2+ : en økning i konsentrasjonen av fritt kalsium i cytosolen aktiverer Ca 2+ -pumpen.
I hvile forekommer nesten ikke diffusjon gjennom kalsiumionekanaler.
Ca-ATPase transporterer Ca fra cellen til det ekstracellulære miljøet mot konsentrasjonsgradienten. Langs gradienten kommer Ca + inn i cellen på grunn av diffusjon gjennom ionekanaler.
Membranen til det endoplasmatiske retikulum inneholder også en stor mengde Ca++ -ATPase.
Kalsiumpumpen til endoplasmatisk retikulum (SERCA) sørger for fjerning av kalsium fra cytosol til endoplasmatisk retikulum – "depot" av kalsium på grunn av primær aktiv transport.
I depotet binder kalsium seg til kalsiumbindende proteiner (calsequestrin, calreticulin, etc.).
Minst tre forskjellige isoformer av SERCA-pumper har blitt beskrevet så langt.
SERCA1-subtypen er utelukkende konsentrert i raske skjelettmuskler, mens SERCA2-pumpene er utbredt i andre vev. Betydningen av SERCA3-pumper er mindre klar.
SERCA2-nacos-proteiner er delt inn i to forskjellige isoformer: SERCA2a, karakteristisk for kardiomyocytter og glatte muskler, og SERCA2b, karakteristisk for hjernevev.
En økning i Ca 2+ i cytosol aktiverer opptaket av kalsiumioner i det endoplasmatiske retikulum, mens en økning i fritt kalsium i det endoplasmatiske retikulum hemmer SERCA-pumpene.
H + K + -ATPase (pumpe).
Ved hjelp av denne pumpen (som et resultat av hydrolysen av ett ATP-molekyl) i slimhinnen (parietalcellene) i mageslimhinnen, transporteres to kaliumioner fra det ekstracellulære rommet til cellen og to H+-ioner fra cytosolen. til det ekstracellulære rommet under hydrolysen av ett molekyl. Denne mekanismen ligger til grunn for dannelsen av saltsyre i magen.
IonepumpeklasseF.
Mitokondriell ATPase. Katalyserer det siste trinnet i ATP-syntese. Mitokondrielle krypter inneholder ATP-syntase, som kobler oksidasjon i Krebs-syklusen og ADP-fosforylering til ATP.
IonepumpekvalitetV.
Lysosomal H + -ATPase (lysosomal protonpumper) - protonpumper som sørger for transport av H + fra cytosol til en rekke lysosomorganeller, Golgi-apparatet, sekretoriske vesikler. Som et resultat synker pH-verdien for eksempel i lysosomer til 5,0, noe som optimerer aktiviteten til disse strukturene.
Funksjoner ved ionetransport
1. Betydelig og asymmetrisk transmembran! gradient for Na+ og K+ i hvile.
Natrium utenfor cellen (145 mmol/l) er 10 ganger større enn i cellen (14 mmol/l).
Det er omtrent 30 ganger mer kalium i cellen (140 mmol/l) enn utenfor cellen (4 mmol/l).
Denne funksjonen ved fordelingen av natrium- og kaliumioner:
homeostatisert av arbeidet til Na + /K + -nacoca;
danner i ro den utgående kaliumstrømmen (lekkasjekanal);
genererer hvilepotensial;
arbeidet til eventuelle kaliumkanaler (spenningsavhengig, kalsiumavhengig, ligandavhengig) er rettet mot dannelsen av den utgående kaliumstrømmen.
Dette returnerer enten tilstanden til membranen til sitt opprinnelige nivå (aktivering av spenningsavhengige kanaler i repolariseringsfasen), eller hyperpolariserer membranen (kalsiumavhengige, ligandavhengige kanaler, inkludert de som aktiveres av systemer med andre mediatorer).
Det bør huskes at:
bevegelsen av kalium over membranen utføres ved passiv transport;
dannelsen av eksitasjon (aksjonspotensial) er alltid på grunn av den innkommende natriumstrømmen;
aktivering av eventuelle natriumkanaler forårsaker alltid en innadgående natriumstrøm;
bevegelsen av natrium over membranen utføres nesten alltid ved passiv transport;
i epitelceller som danner en vegg av ulike rør og hulrom i vev (tynntarm, nefrontubuli, etc.), i den ytre membranen er det alltid et stort antall natriumkanaler som gir en innkommende natriumstrøm når de aktiveres, og i kjellermembran - et stort antall natrium-, kaliumpumper som pumper natrium ut av cellen. En slik asymmetrisk fordeling av disse transportsystemene for natrium sikrer dens transcellulære transport, dvs. fra tarmens lumen, nyretubuli inn i det indre miljøet i kroppen;
passiv transport av natrium inn i cellen langs den elektrokjemiske gradienten fører til akkumulering av energi, som brukes til sekundær aktiv transport av mange stoffer.
2. Lavt nivå av kalsium i cytosolen til cellen.
I cellen i hvile er kalsiuminnholdet (50 nmol/l) 5000 ganger lavere enn utenfor cellen (2,5 mmol/l).
Et så lavt nivå av kalsium i cytosolen er ikke tilfeldig, siden kalsium i konsentrasjoner 10–100 ganger høyere enn den opprinnelige fungerer som en andre intracellulær mediator i signalrealisering.
Under slike forhold er en rask økning av kalsium i cytosolen mulig på grunn av aktivering av kalsiumkanaler (tilrettelagt diffusjon), som er tilstede i store mengder i den cytoplasmatiske membranen og i membranen til endoplasmatisk retikulum (endoplasmatisk retikulum - "depot" " av kalsium i cellen).
Dannelsen av kalsiumflukser, som oppstår på grunn av åpning av kanaler, gir en fysiologisk signifikant økning i kalsiumkonsentrasjonen i cytosolen.
Det lave nivået av kalsium i cytosolen til cellen opprettholdes av Ca 2+ -ATPase, Na + /Ca 2+ -utvekslere, kalsiumbindende proteiner i cytosolen.
I tillegg til den raske bindingen av cytosolisk Ca 2+ av intracellulære Ca 2+-bindende proteiner, kan kalsiumioner som kommer inn i cytosolen akkumuleres av Golgi-apparatet eller cellekjernen og fanges opp av mitokondrielle Ca 2+-depoter.
3. Lavt nivå av klor i cellen.
I cellen i ro er innholdet av klor (8 mmol/l) mer enn 10 ganger lavere enn utenfor cellen (110 mmol/l).
Denne tilstanden opprettholdes ved drift av K + /Cl- -transportøren.
Endringen i den funksjonelle tilstanden til cellen er assosiert (eller forårsaket) med en endring i permeabiliteten til membranen for klor. Ved aktivering av spennings- og ligandstyrte kloridkanaler går ionet inn i cytosolen gjennom kanalen ved passiv transport.
I tillegg dannes klorinngangen i cytosolen av Na+/K+/2CH-kotransportøren og CG-HCO3-veksleren.
Inntreden av klor i cellen øker polariteten til membranen opp til hyperpolarisering.
Funksjoner ved ionetransport spiller en grunnleggende rolle i dannelsen av bioelektriske fenomener i organer og vev som koder for informasjon, bestemmer den funksjonelle tilstanden til disse strukturene, deres overgang fra en funksjonell tilstand til en annen.
Ionekanaler er dannet av proteiner, de er svært forskjellige i struktur og mekanisme for deres virkning. Mer enn 50 typer kanaler er kjent, hver nervecelle har mer enn 5 typer kanaler. Aktiveringstilstanden til en kontrollert ionekanal varer vanligvis omtrent 1 ms, noen ganger opptil 3 ms og mye mer, mens 12–20 millioner ioner kan passere gjennom én kanal.
Ionekanaler er klassifisert etter flere kriterier.
I henhold til muligheten for å kontrollere funksjonen deres, skilles kontrollerte og ukontrollerte kanaler (ionelekkasjekanaler). Gjennom ukontrollerte kanaler beveger ioner seg konstant, men sakte, selvfølgelig, i nærvær av en elektrokjemisk gradient, som i tilfellet med rask bevegelse av ioner gjennom kontrollerte kanaler. Kontrollerte kanaler har porter med sine kontrollmekanismer, slik at ioner kan passere gjennom dem bare når portene er åpne.
I henhold til bevegelseshastigheten til ioner, kan kanalene være raske og langsomme. For eksempel oppstår et aksjonspotensial i skjelettmuskulatur som følge av aktivering av raske Na- og K-kanaler. I utviklingen av aksjonspotensialet til hjertemuskelen, sammen med raske kanaler for Na + og K +, spiller langsomme kanaler - kalsium, kalium og natrium - en viktig rolle.
Avhengig av stimulansen, aktiverende eller inaktiverende, er det flere typer gatede ionekanaler:
- a) potensielt sensitiv
- b) kjemosensitiv,
- c) mekanosensitiv,
- d) kalsiumfølsom
- e) kanaler som er følsomme for andre mellomledd.
Sistnevnte er lokalisert i intracellulære membraner, de er ikke godt forstått, så vel som kalsiumfølsomme kanaler. Når en mediator (ligand) interagerer med reseptorer lokalisert på overflaten av cellemembranen, kan portene til kjemosensitive kanaler åpnes; derfor kalles de også reseptor-gatede kanaler. L og gand er et biologisk aktivt stoff eller farmakologisk medikament som aktiverer eller blokkerer reseptoren. Åpningen av kjemosensitive kanaler skjer som et resultat av konformasjonsendringer i reseptorkomplekset. Portene til spenningsstyrte kanaler åpnes og lukkes når membranpotensialet endres. Derfor, i utformingen av deres portmekanisme, må det være partikler som bærer en elektrisk ladning. Mekanosensitive kanaler aktiveres og inaktiveres ved kompresjon og strekking. Kalsiumfølsomme kanaler aktiveres, som navnet tilsier, av kalsium, og Ca2+ kan aktivere både sine egne kanaler, for eksempel Ca-kanaler i det sarkoplasmatiske retikulum, og kanaler til andre ioner, for eksempel kanaler av K+-ioner. Membranene til eksitable celler (glatt og tverrstripete muskler, inkludert hjertemuskelen, nervesystemet) inneholder potensielle, kjemo-, mekano- og kalsiumfølsomme kanaler. Det bør bemerkes at kalsiumfølsomme kanaler er ett eksempel på kjemosensitive kanaler.
Avhengig av selektiviteten er det ioneselektive kanaler som lar bare ett ion passere, og kanaler som ikke har selektivitet. Det er Na-, K-, Ca-, C1- og Na/Ca-selektive kanaler. Det er kanaler som passerer flere ioner, for eksempel Na+, K+ og Ca2+ i myokardceller, dvs. mangler selektivitet. Høyeste grad av selektivitet for potensialsensitive (spenningsavhengige) kanaler er noe lavere for kjemosensitive (reseptoravhengige) kanaler. For eksempel, når acetylkolin virker på den H-kolinerge reseptoren til den postsynaptiske membranen i den nevromuskulære synapsen, aktiveres ionekanaler, gjennom hvilke Na +, K + og Ca2 + ioner passerer samtidig. Mekanosensitive kanaler er generelt ikke-selektive for monovalente ioner og Ca2+.
Ett og samme ion kan ha flere typer kanaler. De viktigste av dem for dannelsen av biopotensialer er følgende.
Kanaler for K+:
- a) ukontrollerte hvilekanaler (lekkasjekanaler) gjennom hvilke K + hele tiden forlater cellen, som er hovedfaktoren i dannelsen av membranpotensialet (hvilepotensial);
- b) spenningsfølsomme kontrollerte K-kanaler;
- c) K-kanaler aktivert av Ca2+;
- d) kanaler aktivert av andre ioner og stoffer, som acetylkolin, som gir hyperpolarisering av hjertemyocytter.
Kanaler for Na+ -- kontrollert raskt og sakte og ukontrollert (ionelekkasjekanaler):
- a) spenningsfølsomme raske Na-kanaler - raskt aktivert med en reduksjon i membranpotensialet, gir Na + inngang i cellen under dens eksitasjon;
- b) reseptorkontrollerte Na-kanaler aktivert av acetylkolin i den nevromuskulære synapsen, glutamat - i synapsene til CNS-neuroner;
- c) langsomme ukontrollerte Na-kanaler - lekkasjekanaler gjennom hvilke Na + hele tiden diffunderer inn i cellen og bærer andre molekyler med seg, som glukose, aminosyrer, bærermolekyler. Dermed gir Na-lekkasjekanaler sekundær transport av stoffer og deltakelse av Na+ i dannelsen av membranpotensialet.
Kanaler for Ca2+ er svært forskjellige og mest komplekse: reseptor-gatede og spennings-gatede, sakte og raske:
- a) langsomme kalsiumspenningsfølsomme kanaler (nytt navn: L-type), som langsomt aktiveres under depolarisering av cellemembranen, forårsaker langsom inntreden av Ca2+ i cellen og sakte kalsiumpotensial, for eksempel i kardiomyocytter. Tilgjengelig i tverrstripete og glatte muskler, i CNS-neuroner;
- b) raske kalsiumpotensialfølsomme kanaler i det sarkoplasmatiske retikulum sikrer frigjøring av Ca2+ inn i hyaloplasma og elektromekanisk kobling.
Kanaler for klor finnes i skjelett- og hjertemyocytter, erytrocytter, i en liten mengde i nevroner og er konsentrert i synapser. Potensial-gatede C1-kanaler er tilstede i kardiomyocytter, reseptor-gatede i CNS-synapser, og aktiveres av hemmende mediatorer GABA og glycin.
Struktur av ionekanaler og deres funksjon. Kanalene har en munn og et selektivt filter, og kontrollerte kanaler har en portmekanisme; kanalene er fylt med væske, deres dimensjoner er 0,3–0,8 nm. Selektiviteten til ionekanaler bestemmes av deres størrelse og tilstedeværelsen av ladede partikler i kanalen. Disse partiklene har en ladning motsatt ladningen til ionet de tiltrekker seg, noe som sikrer at ionet passerer gjennom denne kanalen (som ladninger er kjent for å frastøte). Uladede partikler kan også passere gjennom ionekanaler. Ioner som passerer gjennom kanalen må kvitte seg med hydreringsskallet, ellers vil dimensjonene deres være større enn kanaldimensjonene. Diameteren til Na+-ionet, for eksempel, med et hydratisert skall er 0,3 nm, og uten et hydratisert skall, 0,19 nm. Et ion som er for lite, som passerer gjennom et selektivt filter, kan ikke gi opp et hydreringsskall, så det kan ikke passere gjennom kanalen. Imidlertid ser det ut til å være andre mekanismer for cellemembranselektivitet. "Silte"-hypotesen er for eksempel ikke i stand til å forklare hvorfor K+ ikke passerer gjennom åpne Na-kanaler i begynnelsen av celleeksitasjonssyklusen, men gir likevel en tilfredsstillende, og i noen tilfeller absolutt overbevisende forklaring på den selektive ( selektiv) permeabilitet av cellemembraner for forskjellige partikler og ioner.
Kanaler av samme type kan gjensidig påvirke hverandre. Dermed bidrar åpningen av noen elektrisk kontrollerte kanaler til aktiveringen av tilstøtende elektrisk følsomme kanaler, mens åpningen av en kjemo- eller mekanosensitiv kanal og passasje av ioner gjennom den praktisk talt ikke påvirker tilstanden til nærliggende lignende kanaler. Delvis depolarisering av cellemembranen på grunn av aktivering av mekanosensitive kanaler kan føre til aktivering av spenningssensitive Na+, K+ (eller Cl-) og Ca2+ kanaler.
Ionekanaler blokkeres av spesifikke stoffer og farmakologiske preparater, som er mye brukt til terapeutiske formål. En spesifikk blokkering av mekanosensitive kanaler er Gadolinium (Gd3+). Blokkere av ulike potensielt sensitive kanaler er forskjellige medikamenter eller kjemikalier. For eksempel er atropin en blokker av den kjemosensitive (reseptorfølsomme) kanalen til effektorceller aktivert av acetylkolin. Potensialavhengige Na-kanaler blokkeres av tetrodotoksin (virker bare utenfor cellen); kalsium - toverdige ioner, som nikkelioner, mangan, samt verapamil, nifedipin. Antallet ionekanaler på cellemembranen er enormt. Dermed er det omtrent 50 Na-kanaler per 1 µm2, i gjennomsnitt er de plassert i en avstand på 140 nm fra hverandre. Vellykket studie av ionekanaler gjør det mulig å bedre forstå virkningsmekanismen til farmakologiske legemidler, og derfor mer vellykket anvende dem i klinisk praksis. Novocain, for eksempel, som lokalbedøvelse lindrer smerte fordi det, ved å blokkere Na-kanaler, stopper ledningen av eksitasjon langs nervefibrene.
Energiforbruk under transport av stoffer gjennom membranen. En betydelig del av energien brukes på prosessene for transport av stoffer i kroppen. Ikke desto mindre utføres transporten av stoffer veldig økonomisk, siden transporten av noen partikler vanligvis sikrer overgangen til andre, som det fremgår av mange fakta.
Under driften av Na/K-pumpen brukes energi på overføring av Na+ fra cellen til dens omgivelser, mens overføringen av K+ inn i cellen skjer uten direkte energiforbruk som følge av konformasjonen av proteinmolekylet ( Na/K-ATPase) etter tilsetning av K+ til det aktive området hennes.
Opprettelsen av en konsentrasjonsgradient av ioner, som er årsaken til membranpotensialet, danner samtidig en osmotisk gradient, som igjen skaper forutsetningene for den rettede bevegelsen av vann. Den opprettede elektriske gradienten tar del i overføringen av ladede partikler, sikrer fremveksten av et aksjonspotensial og forplantningen av eksitasjon.
Prosessen med å flytte vann fra ett område til et annet, i henhold til osmoseloven, sikrer transport av alle partikler som er oppløst i det og i stand til å passere gjennom biologiske filtre (etter løsningsmidlet). Energi brukes ikke direkte på overgang av vann (sekundær transport), naturlig nok brukes ikke energi på overføring av partikler oppløst i vann, som følger med vann.
Natriumavhengig transport (transport av ikke-elektrolytter) krever energi for å overføre Na + fra cellen, men diffusjon av Na + inn i cellen sikrer ofte bevegelse av membranbærere knyttet til glukosemolekyler og aminosyrer. Derfor kan glukose og aminosyrer komme inn i cellen sammen med Na+ (symport). Gjenopptaket av mediatoren til den presynaptiske terminalen fra den synaptiske kløften i synapsene til CNS utføres også ved hjelp av en lignende mekanisme. Natriumavhengig transport kan også gi skyttelbevegelser av bærermolekyler, som igjen transporterer Ca2+, H+ ioner ut av cellen (mottransport, antiport) i henhold til konsentrasjonsgradienten til bærere.
Glukose og aminosyrer transporteres ved tilrettelagt diffusjon sekundært aktivt uten direkte energiforbruk.
Diffusjon av gasser i lungene mellom luft og blod, samt i vev mellom blod og interstitium, skjer uten energiforbruk i det hele tatt, og det samme gjør utveksling av HCO3 og Cl-ioner mellom erytrocytter og plasma når blod er i ulike vev i kropp og lunger. Diffusjon av stoffer fra tarmen, for eksempel glukose til blodet etter inntak med mat, hvis konsentrasjonen i tarmen er større, skjer i henhold til en konsentrasjonsgradient, for dannelsen som kroppens celler ikke bruker energi til. Disse to tilfellene (diffusjon av gasser i lungen, vev og partikler i tarmen) er et unntak, når transport i kroppen utføres uten energiforbruk i det hele tatt. Imidlertid brukes energi på å levere disse stoffene til kroppen - pustebevegelser, matlaging og bearbeiding av det i fordøyelsessystemet.
Energien som brukes av hjertet på bevegelsen av blod gjennom karene sikrer ikke bare transport av alle stoffer, inkludert gasser, av blodet, men også dannelsen av et filtrat (bevegelsen av alle partikler) i kroppens vev. og urindannelse.
Dermed sikrer den primære transporten av flere ioner, hvorav den viktigste er Na +, overføringen av de aller fleste stoffer i kroppen.
Alle typer transport spiller en viktig rolle i livet til cellene og kroppen som helhet. Spesielt sikrer transport av ioner dannelsen av membranpotensialer til cellene i muskel- og nervevev, en av funksjonene til sistnevnte er reguleringen av forskjellige kroppssystemer.